题目内容
8.下列说法正确的是( )| A. | 水的离子积常数量KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 | |
| B. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 室温下,CH3COOH的KW=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O中的c(OH-)相等 |
分析 A.加强酸强碱盐(如NaCl)不影响水的电离;
B.溶度积常数是温度的函数,只受温度的影响;
C.加入NH4Cl,抑制了氨水的电离,氢氧根离子浓度减小;根据电离平衡常数可知c(NH4+)/c(NH3•H2O)=$\frac{{K}_{b}}{c(O{H}^{-})}$,据此判断该比值变化;
D.没有告诉溶液的浓度,无法计算溶液中c(H+)、c(OH-).
解答 解:A.水的离子积与温度有关,但加强酸强碱盐(如NaCl)不影响水的电离,故A错误;
B.溶度积常数是温度的函数,只受温度的影响,与溶液中离子浓度大小无关,故B错误;
C.加入NH4Cl,NH3•H2O?NH4++OH-平衡向逆反应方向移动,氢氧根离子浓度减小,溶液的pH减小,根据电离平衡常数可知c(NH4+)/c(NH3•H2O)=$\frac{{K}_{b}}{c(O{H}^{-})}$的值增大,故C正确;
D.只知道平衡常数,不知溶液的浓度,无法计算溶液中c(H+)、c(OH-),故D错误;
故选C.
点评 本题考查电离平衡及其影响,题目难度不大,明确弱电解质的电离平衡及其影响因素为解答关键,D为易错点,注意题中缺少溶液体积,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
10.下列说法正确的是( )
| A. | 自然界中所有金属都以化合态形式存在 | |
| B. | 化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低 | |
| C. | 废旧金属处理的最好办法是深埋 | |
| D. | 冶炼金属的一般步骤是:浮选富集→冶炼→精炼 |
16.下列化学用语或图示表达正确的是( )
| A. | CO2的电子式: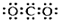 | B. | Na+的结构示意图: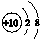 | ||
| C. | 氯离子:Cl | D. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl |
13.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸溶液没有产生白色沉淀,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
 ;DCH3CHCl2或CH2ClCH2Cl;ECH2BrCH2Br;FCH3CHBr2;G
;DCH3CHCl2或CH2ClCH2Cl;ECH2BrCH2Br;FCH3CHBr2;G .
.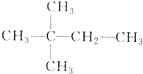 ,则A的结构简式为
,则A的结构简式为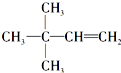 ;A加氢产物的一氯代物有3种.
;A加氢产物的一氯代物有3种.