题目内容
11.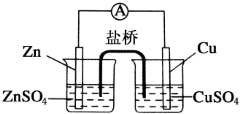 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:(1)此装置工作时,可以观察到的现象是:Zn电极逐渐变细;Cu电极逐渐变粗,电池总反应式为:Zn+Cu2+═Zn2++Cu.
(2)以上电池中,锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池,中间通过盐桥连接起来.
(3)电池工作时,硫酸锌溶液中SO42-向左移动,硫酸铜溶液中SO42-向左移动.
(4)此盐桥内为饱和KCl溶液,盐桥是通过离子移动来导电的.在工作时,K+移向硫酸铜溶液.
分析 (1)原电池中负极失电子,正极上溶液中的铜离子得电子,电池总反应为铜离子与锌之间的置换反应;
(2)锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池;
(3)原电池中阴离子向负极移动;
(4)盐桥是通过离子移动导电,阴离子向负极移动,阳离子向正极移动.
解答 解:(1)原电池中负极失电子,锌失电子作负极,锌电极逐渐变细,正极上溶液中的铜离子得电子生成铜单质,所以铜电极逐渐变粗,电池总反应为Zn+Cu2+═Zn2++Cu;故答案为:Zn电极逐渐变细;Cu电极逐渐变粗;Zn+Cu2+═Zn2++Cu;
(2)锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池,故答案为:锌半电池;铜半电池;
(3)原电池中阴离子向负极移动,溶液中阴离子向负极移动,即硫酸锌溶液中SO42-向左移动,硫酸铜溶液中SO42-向左移动,故答案为:左;左;
(4)盐桥内为饱和KCl溶液,盐桥是通过离子移动导电,阳离子移向正极,即盐桥中K+向硫酸铜溶液移动,故答案为:离子;硫酸铜溶液.
点评 本题考查原电池原理,题目难度中等,注意把握正负极的判断和电子、电流和离子的移动方向.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
1.下列关于糖类、油脂、蛋白质的说法不正确的是( )
| A. | 用碘水可以鉴别葡萄糖溶液和淀粉溶液 | |
| B. | 淀粉、油脂和蛋白质在一定条件下都能发生水解反应 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 向蛋白质溶液中加入浓的CuSO4溶液均可使蛋白质盐析而分离提纯 |
2.设NA为阿伏加德罗常数值.下列有关叙述错误的是( )
| A. | 2.3 g Na在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6 L NHs中含有的氢原子数目为0.75NA | |
| C. | 1 L 0.1 mol/LH3PO4溶液中含有的离子数目为0.4NA | |
| D. | 1个CO2分子的质量为$\frac{44}{{N}_{A}}$g |
6.小李学习了水的有关知识后,自制了如图所示的简易净水器,下列说法正确的是( )
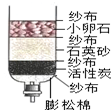

| A. | 该净水器中的活性炭起吸附作用 | B. | 该净水器可以降低自来水的硬度 | ||
| C. | 该净水器能起到杀菌消毒的作用 | D. | 该净水器可将自来水变为蒸馏水 |
16.下列除杂的方法正确是( )
| A. | 除去CO2中的少量CO:点燃,收集气体 | |
| B. | 除去H2中的少量HCl:通入Na2CO3溶液,收集气体 | |
| C. | 除去NaCl溶液中少量CaCl2,加入过量Na2CO3溶液,过滤 | |
| D. | 除去BaSO4中少量BaCO3:加入过量稀盐酸,过滤 |
19.下列说法中,正确的是( )
| A. | 最外层电子数为1的原子都为金属元素的原子 | |
| B. | 最外层电子数为8的微粒是稀有气体元素的原子 | |
| C. | 在元素周期表里,元素所在的周期数等于原子核外电子层数 | |
| D. | 在元素周期表里,主族元素所在的族的序数等于原子核外电子数 |
20.室温下,有pH=3的盐酸、硫酸、醋酸(假设HAc的电离度为1%)三种相同体积的溶液.以下叙述错误的是( )
| A. | 测定其导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:1:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:2:100 |