题目内容
20.无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇到水蒸气会产生白色烟雾.探究一 无水AlCl3的实验室制备
利用下图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液

(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,然后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管
b.往A烧瓶中加入液体
c.点燃A中的酒精灯
(3)上述供选药品中本实验无需用到的是③⑦(填数字序号).
(4)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(6)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②:
①制备的氯气不足 ②固体和气体无法充分接触 ③无水AlCl3发生升华,造成损失
探究三 离子浓度对氯气制备的影响
二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应停止不再产生氯气.探究小组对盐酸浓度降低影响氯气生成的原因进行如下探究:
(7)提出假设 假设1:Cl-浓度降低影响氯气的生成
假设2:H+浓度降低影响氯气的生成.
(8)设计方案进行实验.限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸.
| 步骤 | 实验操作 | 预测现象和结论 |
| ① | 往不再产生氯气的装置中,加入NaCl固体,继续加热 | 若有黄绿色气体生成,则假设1成立 |
| ② | 往不再产生氯气的装置中,加入浓硫酸并继续加热 | 若有黄绿色气体生成,则假设2成立 |
分析 本题分三块,制备氯化铝、氯化铝的纯度分析、探究实验室制氯气的反应原理,其中氯化铝制备是利用二氧化锰和浓盐酸混合加热制得氯气与铝粉共热制备氯化铝,实验过程中要关注氯气的净化、保持无氧环境(防止生成氧化铝)、干燥环境(防氯化铝水解),并进行尾气处理减少对环境的污染;氯化铝样品中可能混有铝,利用铝与氢氧化钠溶液反应生成的氢气测定铝的含量,再计算出氯化铝的纯度;探究实验室制备氯气的原理可从来二个方面分析(1)氯离子浓度对实验的影响(2)H+对实验的影响;
(1)实验室是利用二氧化锰与浓盐酸混合加热制氯气的,可据此写出反应化学方程式;
(2)实验前装置里充满空气,空气时有氧气,必须先利用生成的氯气除去,否则制得的氯化铝中会混有氧化铝,根据此思路确定操作顺序;
(3)实验操作过程中制氯气需要浓盐酸和二氧化锰,除氯气中混合的氯化氢需要饱和食盐水,干燥氯气需要浓硫酸,铝粉参加氯气的氧化制氯化铝,用氯化钙作干燥剂防水汽进入硬质管内,用氢氧化钠溶液吸收含有氯气的尾气,由此可看出不需要的化学药品;
(4)无水AlCl3与水蒸气发生的是水解反应;
(5)根据三次实验生成的氢气求平均值,再根据生成的氢气求出参加反应的铝,即可计算出氯化铝的质量分数;
(6)氯化铝的含量偏低,除部分不参加反应的铝外,还可能有部分铝被氧气氧化;
(7)二氧化锰与浓盐酸反应的离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,可见影响反应进行离子应该是氯离子或氢离子的浓度;
(8)选择试剂时要注意,考虑氯离子时不要影响H+的浓度,同理考虑氢离子时不能影响氯离子浓度,故探究氯离子浓度的影响,只要通过氯化钠补充氯离子就可以了,探究H+浓度的影响只要探究添加浓硫酸补充H+就可以了.
解答 解:(1)实验室用二氧化锰与浓盐酸反应制氯气的反应方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)实验开始前,先检查装置气密性,然后装入药品,接下来先添加浓盐酸再加热A中酒精灯,待硬质玻璃管中充满黄绿色气体后再加热D装置,正确操作顺序为bca,故答案为:bca;
(3)实验过程中要关注氯气的净化、保持无氧环境(防止生成氧化铝)、干燥环境(防氯化铝水解),并进行尾气处理减少对环境的污染,可知不需要的药品是稀盐酸、稀硫酸即③⑦,故答案为:③⑦;
(4)无水氯化铝遇水蒸汽,Al3+的水解在受热条件下反应快速进行,反应方程式为AlCl3+3H2O(g)=Al(OH)3+3HCl,故答案为:AlCl3+3H2O(g)=Al(OH)3+3HCl;
(5)三次实验收集到的氢气平均值为(334.5mL+336.0mL+337.5mL)÷3=336.0mL,氢气的物质的量为$\frac{336×1{0}^{-3}L}{22.4L/mol}$=0.015mol,根据2Al~3H2,可知铝的物质的量为$\frac{0.015mol×2}{3}$=0.01mol,质量为0.01mol×27g/mol=0.27g,氯化铝的质量分数为$\frac{2.0g-0.27g}{2.0g}×100%$=86.5%,故答案:86.5%;
(6)氯气量不足,部分铝未反应生成氯化铝,可导致氯化铝含量偏低;固体和气体无法充分接触,部分铝粉未被氯气氧化,混有铝,导致氯化铝含量偏低;有少量氯化铝升华,也能导致氯化铝含量偏低;故答案为:①②③;(7)根据实验室利用浓盐酸和二氧化锰混合加热反应原理可知,参加离子反应的离子为氯离子和氢离子,另一种假设为H+浓度影响氯气的生成,故答案为:H+浓度影响氯气的生成;
(8)可通过向反应装置中添加NaCl固体的方法增加溶液里的氯离子浓度,添加浓硫酸的方法增加溶液里的H+浓度,故答案为:氯化钠固体;往不再产生氯气的装置中,加入浓硫酸并继续加热.
点评 本题综合程度较高,考查了氯气与氯化铝的制备,探究了氯化铝含量测定及氯气制备原理,涉及物质的量计算、实验操作的选择等,知识面广,但难度中等,对学生基础要求较高,对学生的解题能力提高有一定帮助.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案| A. | 该溶液中一定含硫酸根离子 | |
| B. | 该溶液中一定含有银离子 | |
| C. | 该溶液中一定含有硫酸根离子和银离子 | |
| D. | 该溶液中可能含有硫酸根离子或银离子 |
(1)请完成下表:
| 甲同学 | 乙同学 | |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | 先产生白色沉淀,然后沉淀逐渐消失 | |
| 化学方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaClAl(OH)3+NaOH=NaAlO2+2H2O | A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 |
| 离子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)实验室制取氢氧化铝最好选用可溶性铝盐和氨水,氢氧化铝可以和氢氧化钠溶液发生反应,和一水合氨不发生反应.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的△H3=-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:
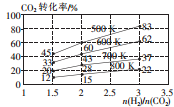
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向逆反应 方向移动.
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2 的转化率为40%.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H.在一定压强下,将2.5molH2与a molCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应叙述正确的是ABC
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长
D.转化率分别为y、w时,平衡常数不同.
| A. | 分别加水稀释10倍,两溶液的pH仍相等 | |
| B. | 温度升高10℃,两溶液的pH均不变 | |
| C. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| D. | 用相同浓度的盐酸中和至反应完全时,消耗盐酸的体积相同 |
| A. | 10 | B. | 3 | C. | 9 | D. | 6 |
| A. | 由H原子形成1 mol H-H键要吸收热量 | |
| B. | 所有燃烧反应都是放热反应 | |
| C. | 在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 | |
| D. | 在一定条件下,1mol H2 与足量的Cl2、Br2、I2 分别反应,放出热量关系是I2>Br2>Cl2 |
 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收: 阿司匹林的相对分子质量为180,是一种常用的药品.
阿司匹林的相对分子质量为180,是一种常用的药品. .
.