题目内容
11.向某溶液中加入BaCl2溶液后观察到白色沉淀,则( )| A. | 该溶液中一定含硫酸根离子 | |
| B. | 该溶液中一定含有银离子 | |
| C. | 该溶液中一定含有硫酸根离子和银离子 | |
| D. | 该溶液中可能含有硫酸根离子或银离子 |
分析 某溶液中加入BaCl2溶液后观察到白色沉淀,该白色沉淀可能是AgCl也可能是BaSO4,据此分析.
解答 解:AgCl和BaSO4都是白色沉淀,某溶液中加入BaCl2溶液后观察到白色沉淀时,不能确定该白色沉淀是AgCl还是BaSO4,所以该溶液中可能含有硫酸根离子或银离子,故选D.
点评 本题考查离子的检验,注重信息的分析、理解能力,难度中等,注意把握常见离子的检验方法,侧重于基础知识的考查..

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
1.下列离子方程式书写正确的是( )
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:2Al3++2NH4++4SO42-+4Ba2++10OH-═2AlO2-+4BaSO4↓+2NH3•H2O+4H2O | |
| B. | 碳酸氢镁溶液中加过量澄清石灰水:Mg2++2OH-+2HCO3-+Ca2+═MgCO3↓+2H2O+CaCO3↓ | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
2.“美丽中国”是十八大提出的重大课题,她突出了生态文明,重点是社会发展与自然环境之间的和谐,下列行为中不符合这一主题的是( )
| A. | 用已脱硫的煤作燃料 | |
| B. | 开发氢能等能源代替化石燃料,有利于保护环境 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
19.下列实验中,颜色的变化与氧化还原反应有关的是( )
| A. | 往紫色石蕊试液中通入氨气,溶液变蓝 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
6.学习化学的目的是运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题.下列说法中你认为不正确的是( )
| A. | 搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖的溶解度 | |
| B. | 天气闷热时,鱼塘的鱼会接近水面游动,原因是温度高压强小,氧气的溶解度小 | |
| C. | 夏天,铜制眼镜架表面出现的绿色物质[主要成分 Cu2(OH)2CO3],可用稀盐酸除去 | |
| D. | 敞口放置的酒精没有燃烧的原因是温度没有达到酒精的着火点 |
20.无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇到水蒸气会产生白色烟雾.
探究一 无水AlCl3的实验室制备
利用下图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液

(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,然后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管
b.往A烧瓶中加入液体
c.点燃A中的酒精灯
(3)上述供选药品中本实验无需用到的是③⑦(填数字序号).
(4)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
(5)根据表中数据,计算所得固体中无水AlCl3的质量分数86.5%;.
(6)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②:
①制备的氯气不足 ②固体和气体无法充分接触 ③无水AlCl3发生升华,造成损失
探究三 离子浓度对氯气制备的影响
二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应停止不再产生氯气.探究小组对盐酸浓度降低影响氯气生成的原因进行如下探究:
(7)提出假设 假设1:Cl-浓度降低影响氯气的生成
假设2:H+浓度降低影响氯气的生成.
(8)设计方案进行实验.限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸.
探究一 无水AlCl3的实验室制备
利用下图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液

(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,然后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管
b.往A烧瓶中加入液体
c.点燃A中的酒精灯
(3)上述供选药品中本实验无需用到的是③⑦(填数字序号).
(4)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(6)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②:
①制备的氯气不足 ②固体和气体无法充分接触 ③无水AlCl3发生升华,造成损失
探究三 离子浓度对氯气制备的影响
二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应停止不再产生氯气.探究小组对盐酸浓度降低影响氯气生成的原因进行如下探究:
(7)提出假设 假设1:Cl-浓度降低影响氯气的生成
假设2:H+浓度降低影响氯气的生成.
(8)设计方案进行实验.限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸.
| 步骤 | 实验操作 | 预测现象和结论 |
| ① | 往不再产生氯气的装置中,加入NaCl固体,继续加热 | 若有黄绿色气体生成,则假设1成立 |
| ② | 往不再产生氯气的装置中,加入浓硫酸并继续加热 | 若有黄绿色气体生成,则假设2成立 |
 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
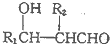 (R1、R2为烃基或H)
(R1、R2为烃基或H)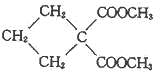 +HBr+HCl
+HBr+HCl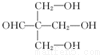 .
. .
.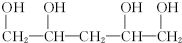 .
.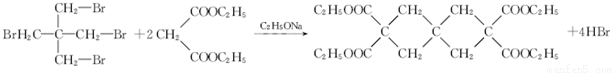 .
.