题目内容
14.已知在K2Cr2O7的溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为溶液橙色加深或溶液颜色加深;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为溶液由橙色变为黄色.分析 在反应Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+中,增大生成物的浓度,平衡逆向移动,减小生成物的浓度,平衡正向移动,以此解答该题.
解答 解:在反应Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+中,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,氢离子浓度增大,平衡逆向移动,则溶液橙色加深或溶液颜色加深,加入NaOH,氢离子浓度减小,平衡正向移动,则溶液由橙色变为黄色,
故答案为:溶液橙色加深或溶液颜色加深;溶液由橙色变为黄色.
点评 本题考查化学平衡的移动,为高频考点,侧重于学生的分析能力的考查,题目侧重浓度对平衡移动的影响,难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
4.已知:CO(g)+2H2(g)?CH3OH(g)△H<0.其它条件不变的情况下,下列有关该反应的说法中正确的是( )
| A. | 升高温度可以提高CO的转化率 | |
| B. | 加入催化剂能提高CO的转化率 | |
| C. | 缩小反应器容积可以使平衡正向移动 | |
| D. | 再充入适量H2,该反应平衡常数的数值会增大 |
5.已知反应:
①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol.
下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol.
下列结论正确的是( )
| A. | 碳的燃烧热小于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
2.下列热化学方程式正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=571.6kJ•mol-1(反应热) |
9.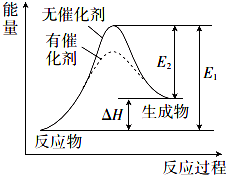 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变(△H) | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
19.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 618 kJ |
6.现有三组溶液:①水和植物油的混合物 ②提取白酒中的乙醇 ③氯化钠和单质溴的混合液.分离以上各混合液的正确方法依次( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |