题目内容
19.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 618 kJ |
分析 焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:1g氢气完全燃烧生成水蒸气时放出热量121kJ,可知H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ/mol,
设1mol H-H键断裂时吸收热量为x,
焓变等于反应物中键能之和减去生成物中键能之和,
则x+$\frac{1}{2}$×496-2×463=-242,
解得x=436kJ,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与计算能力的考查,注意物质中化学键的判断,题目难度不大.

练习册系列答案
相关题目
10.碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
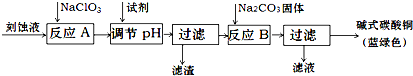
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3(写化学式).
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..
7.处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和无毒的气体.已知:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0kJ•mol-1
下列说法正确的是( )
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0kJ•mol-1
下列说法正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 反应②△H<0,所以该反应能自发进行 | |
| C. | 使用催化剂能提高其转化率 | |
| D. | 根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ•mol-1 |
4.能正确表示下列化学反应的离子方程式的是( )
| A. | 澄清的石灰水与稀硝酸反应:OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸的反应:OH${\;}^{{-}^{\;}}$+H+═H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸溶液与碳酸钙反应:CaCO3+2H+═Ca2++CO2↑+H2O |
11.已知反应:A(g)+4B(s)=2C(g)+D(g)△H<0.则该反应( )
| A. | 能自发进行 | B. | 不能自发进行 | ||
| C. | 可能自发进行 | D. | 在加热条件下才能自发进行 |
8.下列离子方程式正确的是( )
| A. | 碳酸的电离:H2CO3═2H++HCO3- | |
| B. | 将金属钠加入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| D. | 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |