题目内容
5.实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:(1)根据计算得知,所需NaOH的质量为2.0g
(2)下列操作对所配浓度有何影响(填写字母)
偏大的有AC;偏小的有BDEFH;无影响的有G.
A、称量用了生锈的砝码; B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出 E、未洗涤溶解NaOH的烧杯
F、定容时仰视刻度线 G、容量瓶未干燥即用来配制溶液
H、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
分析 (1)依据配制溶液体积选择合适的容量瓶,依据m=CVM计算需要溶质的质量;
(2)分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n增大或者使V减小的操作都会使溶液浓度偏高,反正溶液浓度偏低.
解答 解:(1)实验需要0.1mol/LNaOH溶液450ml,而实验室没有450mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM可知需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
故答案为:2.0;
(2)A、称量用了生锈的砝码,导致称取的溶质的质量偏大,溶质的物质的量偏大,溶液浓度偏大;
B、将NaOH放在纸张上称量,氢氧化钠吸收空气中的水和二氧化碳,导致称取的固体中和含有溶质氢氧化钠的物质的量偏小,溶液浓度偏小;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,冷却后,液面下降,溶液体积偏小,溶液浓度偏大;
D、往容量瓶转移时,有少量液体溅出,导致溶质的物质的量偏小,溶液浓度偏小;
E、未洗涤溶解NaOH的烧杯,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏小;
F、定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏小;
G、容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
H、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低;
所以:偏大的有AC;偏小的有BDEFH;无影响的有G;
故选:AC;BDEFH;G.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,注意配制450mL溶液需要选用500mL容量瓶,本题难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
16.下列说法中正确的是( )
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 | |
| B. | NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 | |
| C. | 蔗糖、乙醇在液态和水溶液里均不导电,所以它们是非电解质 | |
| D. | 烧碱、冰醋酸、石墨均为电解质 |
13.下列措施是为了降低化学反应速率的是( )
| A. | 铁粉代替铁钉与稀硫酸反应制取氢气 | |
| B. | 双氧水制氧气时加入少量二氧化锰 | |
| C. | 镁和水反应时,适当进行加热 | |
| D. | 食品放在冰箱中贮藏 |
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 32g O2含有的氧原子数目为NA | |
| B. | 常温常压下,22.4L CO2含有的分子数目为NA | |
| C. | lmolNa与氧气完全反应生成Na2O2时失去的电子数目为NA | |
| D. | 1mol/L K2CO3溶液中含有的钾离子数目为2NA |
 铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应.请回答下列问题:
铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应.请回答下列问题: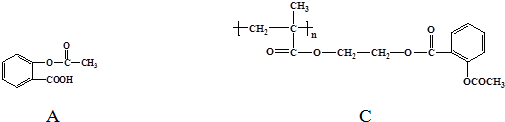
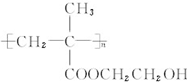 .
.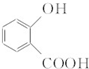 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).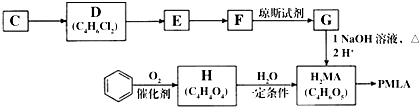


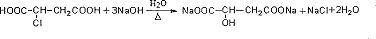
 等.
等.