题目内容
10.已知下列热化学方程式:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是①②③④.
(2)H2的燃烧热为285.8kJ•mol-1;C的燃烧热为393.5kJ•mol-1.
(3)燃烧10g H2生成液态水,放出的热量为1429.0kJ.
(4)CO燃烧的热化学方程式为CO(g)+O2(g)═CO2(g)△H=-283.0kJ•mol-1;其燃烧热△H为-283.0kJ•mol-1.
分析 (1)物质的燃烧均为放热反应;
(2)燃烧热是指在101kP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C元素转化为CO2,H元素转化为液态水,据此分析;
(3)求出氢气的物质的量,然后根据1mol氢气燃烧生成液态水时放出285.8KJ的热量来分析;
(4)根据盖斯定律可知,将④-③可得CO的燃烧反应,即可得反应热.
解答 解:(1)物质的燃烧均为放热反应,而①②为氢气的燃烧,③④为C的燃烧,故①②③④均为放热反应,故答案为:①②③④;
(2)燃烧热是指在101kP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C元素转化为CO2,H元素转化为液态水,故反应①为氢气的燃烧热的热化学方程式,即氢气的燃烧热为285.8kJ•mol-1;反应④为C的燃烧热的热化学方程式,故C的燃烧热为393.5kJ•mol-1,故答案为:285.8 kJ•mol-1;393.5kJ•mol-1;
(3)10g氢气的物质的量为5mol,而1mol氢气燃烧生成液态水时放出285.8KJ,故5mol氢气燃烧生成液态水时放出的热量为285.8kJ•mol-1×5mol=1429.0 kJ,故答案为:1429.0kJ;
(4)根据盖斯定律可知,将④-③可得CO的燃烧反应为:CO(g)+O2(g)═CO2(g)△H=-283.0 kJ•mol-1,故CO的燃烧热△H为-283.0 kJ•mol-1.故答案为:CO(g)+O2(g)═CO2(g)△H=-283.0 kJ•mol-1;-283.0 kJ•mol-1.
点评 本题考查了燃烧热的概念和热化学方程式的书写,难度不大,注意掌握盖斯定律的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.NA 代表阿伏加德罗常数的值.下列说法正确的是( )
| A. | C2H4 和C3H6的混合物的质量为a g,所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 标准状况下,2.24 L 2H35Cl 中所含中子数为1.8NA | |
| C. | 50 mL 12 mol•L-1 盐酸与足量MnO2 共热,转移的电子数为0.3NA | |
| D. | 1 L O.lmol•L-1的NaHCO3 溶液中HCO3-和CO32-的离子数之和为0.1NA |
1.下列物质中,既含有极性键,又含有非极性键的是( )
| A. | 苯(C6H6) | B. | CO2 | C. | Na2O2 | D. | NH4Cl |
18.下列说法不正确的是( )
| A. | 标准状况下,1molNa2O2和22.4LCO2反应,转移电子数为1mol | |
| B. | 将钠投入到CuSO4溶液中,可以置换生成Cu | |
| C. | 将Na2O2投入到FeSO4溶液中,可生成红褐色沉淀 | |
| D. | 常温下铜与稀硫酸不反应,加入KNO3晶体后,可生成气体 |
15.如图所示的某有机反应,其反应类型为( )
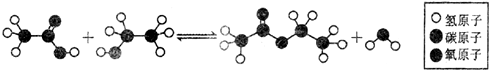

| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 加聚反应 |
2.自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题.
(1)已知N2(g)+O2(g)=2NO(g)△H=+180.5KJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ•mol-1
则加催化剂处理汽车尾气的热化学方程是2CO(g)+2NO(g)=2CO2(g)+N2(g)△H=-746.5KJ•mol-1
(2)反应2NO2(g)?2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如表
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是B
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是ACE
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为0.0015mol•L-1•s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应正向(填“正向”、“逆向”或“不移动”).
(1)已知N2(g)+O2(g)=2NO(g)△H=+180.5KJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ•mol-1
则加催化剂处理汽车尾气的热化学方程是2CO(g)+2NO(g)=2CO2(g)+N2(g)△H=-746.5KJ•mol-1
(2)反应2NO2(g)?2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如表
| 时间(s) | 0 | 10 | 20 | 25 | 30 |
| 条件A[n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
| 条件B[n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是ACE
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为0.0015mol•L-1•s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应正向(填“正向”、“逆向”或“不移动”).


