题目内容
下列实验的操作、现象、结论均正确的是( )
| 选项 | 操作 | 结论 |
| A | 用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 | 该硫酸盐一定含Na+ 一定不含K+ |
| B | 二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 | 酸性条件下NO3-具有强氧化性 |
| C | 在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 | 淀粉没有发生水解 |
| D | 某试样溶液中加入少量稀盐酸,有白色沉淀生成 | 试样中一定含有Ag+ |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.K元素的焰色反应要透过蓝色钴玻璃观察;
B.SO2具有还原性,能被强氧化性物质氧化生成SO4 2-,SO4 2-和Ba 2+反应生成BaSO4 沉淀;
C.葡萄糖和新制Cu(OH)2悬浊液反应必须在碱性条件下;
D.能和稀盐酸反应生成白色沉淀的离子不仅有Ag+.
B.SO2具有还原性,能被强氧化性物质氧化生成SO4 2-,SO4 2-和Ba 2+反应生成BaSO4 沉淀;
C.葡萄糖和新制Cu(OH)2悬浊液反应必须在碱性条件下;
D.能和稀盐酸反应生成白色沉淀的离子不仅有Ag+.
解答:
解:A.K元素的焰色反应要透过蓝色钴玻璃观察,滤去黄光的干扰,所以不透过蓝色钴玻璃观察,不能确定是否含有钾离子,故A错误;
B.二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体,说明二氧化硫、硝酸钡反应生成一氧化氮、硫酸根离子,反应方程式为3SO2+3Ba(NO3)2+2H2O=3BaSO4+2NO+4HNO3、2NO+O2=2NO2,所以该反应体现酸性条件下硝酸根离子的强氧化性,故B正确;
C.淀粉是在酸性条件下水解,葡萄糖和新制Cu(OH)2悬浊液反应必须在碱性条件下,所以要用新制氢氧化铜悬浊液检验葡萄糖时要先中和酸,否则无法成功,故C错误;
D.能和稀盐酸反应生成白色沉淀的离子有Ag+、SiO32-等,故D错误;
故选B.
B.二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体,说明二氧化硫、硝酸钡反应生成一氧化氮、硫酸根离子,反应方程式为3SO2+3Ba(NO3)2+2H2O=3BaSO4+2NO+4HNO3、2NO+O2=2NO2,所以该反应体现酸性条件下硝酸根离子的强氧化性,故B正确;
C.淀粉是在酸性条件下水解,葡萄糖和新制Cu(OH)2悬浊液反应必须在碱性条件下,所以要用新制氢氧化铜悬浊液检验葡萄糖时要先中和酸,否则无法成功,故C错误;
D.能和稀盐酸反应生成白色沉淀的离子有Ag+、SiO32-等,故D错误;
故选B.
点评:本题考查化学方案评价,涉及离子检验、物质检验,侧重考查学生对实验基本操作、实验原理的掌握,明确物质性质及实验操作规范性是解本题关键,易错选项是CD,题目难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
某无色溶液中加入氯化钡后有白色沉淀,再加稀硝酸沉淀不消失,则该溶液中( )
| A、一定含有SO42- |
| B、一定含有Ag+ |
| C、可能含有SO42-或Ag+ |
| D、一定含有Ag+、SO42- |
25℃时,将0.2mol?L-1的HF加水稀释过程中,下列表示的量保持不变的是( )
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
⑤
.
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
| c(H+) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
下列叙述正确的是( )
| A、饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液pH减小 |
| C、盐酸中滴加氨水呈中性,溶液中的溶质为氯化铵 |
| D、向沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
已知0.5LFe2(SO4)3溶液中Fe3+为1mol/L,则下列说法正确的是( )
| A、SO42-浓度为3mol/L |
| B、Fe3+的质量为28g |
| C、Fe2(SO4)3浓度为1mol/L |
| D、SO42-为0.5mol |
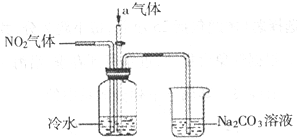
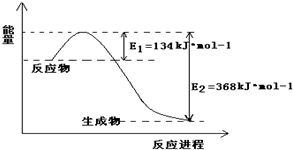 Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式
Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式
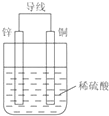 根据铜锌原电池示意图,回答下列问题:
根据铜锌原电池示意图,回答下列问题: