题目内容
如图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物.

I.元素周期表是人们研究物质性质的重要工具Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为 ,当消耗1mol还原剂时,转移的电子个数为 .
Ⅱ.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
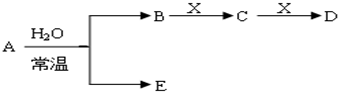
(1)若E为氧化物,则A与水反应的化学方程式为 .
①当X是碱性盐溶液,C分子中有22个电子时,则C的电子式为 ,表示X呈碱性的离子方程式为 .
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,B含有的化学键类型为 ,C与X反应的离子方程式为 .
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方式 .
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 .
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃.该化合物能与水反应放氢气,若将1mol 该化合物和1mol ③形成的单质混合加入足量的水,充分反应后生成气体的体积是 (标准状况下).

I.元素周期表是人们研究物质性质的重要工具Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为氧化物,则A与水反应的化学方程式为
①当X是碱性盐溶液,C分子中有22个电子时,则C的电子式为
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,B含有的化学键类型为
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方式
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃.该化合物能与水反应放氢气,若将1mol 该化合物和1mol ③形成的单质混合加入足量的水,充分反应后生成气体的体积是
考点:无机物的推断,元素周期律和元素周期表的综合应用
专题:
分析:由元素在周期表中位置,可知①为H、②为Na、③为Al、④为C、⑤为N、⑥为O、⑦为Cl.
Ⅰ.Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与Y的水溶液反应,产物有As的最高价含氧酸,即生成H3AsO4,根据化合价升降相等,可知还有NaCl生成;根据转移电子和砷之间的关系式计算转移电子数;
Ⅱ.能和水反应的物质有金属氧化物、非金属氧化物、金属和非金属.
(1)若E为氧化物,常温下与A与水反应生成E,则为二氧化氮与水反应生成硝酸与NO,故A为NO2,B为HNO3,E为NO;
①当X是碱性盐溶液,C分子中有22个电子时,则X为碳酸盐,C为CO2,D为碳酸氢盐;
②当X为金属单质时,由转化关系可知,X为变价金属,故X为Fe,C为硝酸铁,D为硝酸亚铁;
(2)若E为单质气体,D为白色沉淀,则A为Na或过氧化钠,E为氢气或氧气,B为NaOH,X为氯化铝,C为偏铝酸钠,D为氢氧化铝;
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,则该化合物为N2H4,计算1molN2H4燃烧放出的热量,注明聚集状态、反应热,书写热化学方程式;
(4)双氧水有强氧化性,酸性条件下,双氧水能氧化铜生成铜离子同时生成水;
(5)氢气和钠反应生成氢化钠,氢化钠和水反应生成氢氧化钠和氢气,氢氧化钠和铝反应生成氢气,根据方程式:NaH+H2O=NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,1mol氢化钠和水反应生成1mol氢氧化钠和1mol氢气,1mol氢氧化钠和铝反应生成1.5mol氢气.
Ⅰ.Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与Y的水溶液反应,产物有As的最高价含氧酸,即生成H3AsO4,根据化合价升降相等,可知还有NaCl生成;根据转移电子和砷之间的关系式计算转移电子数;
Ⅱ.能和水反应的物质有金属氧化物、非金属氧化物、金属和非金属.
(1)若E为氧化物,常温下与A与水反应生成E,则为二氧化氮与水反应生成硝酸与NO,故A为NO2,B为HNO3,E为NO;
①当X是碱性盐溶液,C分子中有22个电子时,则X为碳酸盐,C为CO2,D为碳酸氢盐;
②当X为金属单质时,由转化关系可知,X为变价金属,故X为Fe,C为硝酸铁,D为硝酸亚铁;
(2)若E为单质气体,D为白色沉淀,则A为Na或过氧化钠,E为氢气或氧气,B为NaOH,X为氯化铝,C为偏铝酸钠,D为氢氧化铝;
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,则该化合物为N2H4,计算1molN2H4燃烧放出的热量,注明聚集状态、反应热,书写热化学方程式;
(4)双氧水有强氧化性,酸性条件下,双氧水能氧化铜生成铜离子同时生成水;
(5)氢气和钠反应生成氢化钠,氢化钠和水反应生成氢氧化钠和氢气,氢氧化钠和铝反应生成氢气,根据方程式:NaH+H2O=NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,1mol氢化钠和水反应生成1mol氢氧化钠和1mol氢气,1mol氢氧化钠和铝反应生成1.5mol氢气.
解答:
解:由元素在周期表中位置,可知①为H、②为Na、③为Al、④为C、⑤为N、⑥为O、⑦为Cl.
Ⅰ.Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与Y的水溶液反应,产物有As的最高价含氧酸,即生成H3AsO4,根据化合价升降相等,可知还有NaCl生成,反应方程式为:5NaClO+2As+3H2O=2H3AsO4+5NaCl,As元素化合价由0计算升高为+5,转移电子数为5,故消耗1mol还原剂时,转移的电子个数为5NA,
故答案为:5NaClO+2As+3H2O=2H3AsO4+5NaCl;5NA;
Ⅱ.能和水反应的物质有金属氧化物、非金属氧化物、金属和非金属.
(1)若E为氧化物,常温下与A与水反应生成E,则为二氧化氮与水反应生成硝酸与NO,故A为NO2,B为HNO3,E为NO,反应方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
①当X是碱性盐溶液,C分子中有22个电子时,则X为碳酸盐,C为CO2,D为碳酸氢盐,则:
C的电子式为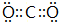 ,表示X呈碱性的离子方程式为:CO32-+H2O?HCO3-+OH-,
,表示X呈碱性的离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为: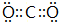 ;CO32-+H2O?HCO3-+OH-;
;CO32-+H2O?HCO3-+OH-;
②当X为金属单质时,由转化关系可知,X为变价金属,故X为Fe,C为硝酸铁,D为硝酸亚铁,则X与B的稀溶液反应生成C的离子反应方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若E为单质气体,D为白色沉淀,则A为Na或过氧化钠,E为氢气或氧气,B为NaOH,X为氯化铝,C为偏铝酸钠,D为氢氧化铝,B(NaOH)含有的化学键类型为:离子键、共价键,C与X反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:离子键、共价键;Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,则该化合物为N2H4,1molN2H4燃烧放出的热量为31.2kJ×
=624kJ,该反应热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ?mol-1,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ?mol-1;
(4)双氧水有强氧化性,酸性条件下,双氧水能氧化铜生成铜离子同时生成水,反应离子方程式为:Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(5)氢气和钠反应生成氢化钠,氢化钠和水反应生成氢氧化钠和氢气,氢氧化钠和铝反应生成氢气,反应方程式为:NaH+H2O=NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1mol氢化钠和水反应生成1mol氢氧化钠和1mol氢气,1mol氢氧化钠和铝反应生成1.5mol氢气,故标况下生成氢气体积为(1mol+1.5mol)×22.4L/mol=56L,故答案为:56L.
Ⅰ.Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与Y的水溶液反应,产物有As的最高价含氧酸,即生成H3AsO4,根据化合价升降相等,可知还有NaCl生成,反应方程式为:5NaClO+2As+3H2O=2H3AsO4+5NaCl,As元素化合价由0计算升高为+5,转移电子数为5,故消耗1mol还原剂时,转移的电子个数为5NA,
故答案为:5NaClO+2As+3H2O=2H3AsO4+5NaCl;5NA;
Ⅱ.能和水反应的物质有金属氧化物、非金属氧化物、金属和非金属.
(1)若E为氧化物,常温下与A与水反应生成E,则为二氧化氮与水反应生成硝酸与NO,故A为NO2,B为HNO3,E为NO,反应方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
①当X是碱性盐溶液,C分子中有22个电子时,则X为碳酸盐,C为CO2,D为碳酸氢盐,则:
C的电子式为
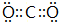 ,表示X呈碱性的离子方程式为:CO32-+H2O?HCO3-+OH-,
,表示X呈碱性的离子方程式为:CO32-+H2O?HCO3-+OH-,故答案为:
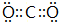 ;CO32-+H2O?HCO3-+OH-;
;CO32-+H2O?HCO3-+OH-;②当X为金属单质时,由转化关系可知,X为变价金属,故X为Fe,C为硝酸铁,D为硝酸亚铁,则X与B的稀溶液反应生成C的离子反应方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若E为单质气体,D为白色沉淀,则A为Na或过氧化钠,E为氢气或氧气,B为NaOH,X为氯化铝,C为偏铝酸钠,D为氢氧化铝,B(NaOH)含有的化学键类型为:离子键、共价键,C与X反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:离子键、共价键;Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,则该化合物为N2H4,1molN2H4燃烧放出的热量为31.2kJ×
| 1mol×32g/mol |
| 1.6g |
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ?mol-1;
(4)双氧水有强氧化性,酸性条件下,双氧水能氧化铜生成铜离子同时生成水,反应离子方程式为:Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(5)氢气和钠反应生成氢化钠,氢化钠和水反应生成氢氧化钠和氢气,氢氧化钠和铝反应生成氢气,反应方程式为:NaH+H2O=NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1mol氢化钠和水反应生成1mol氢氧化钠和1mol氢气,1mol氢氧化钠和铝反应生成1.5mol氢气,故标况下生成氢气体积为(1mol+1.5mol)×22.4L/mol=56L,故答案为:56L.
点评:本题考查无机物推断,题目比较综合,涉及元素周期表、氧化还原反应、盐类水解、电子式、离子方程式、热化学方程式、化学键等知识,是对知识的综合应用,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、25℃时,pH为9的Na2CO3溶液和pH为5的NaHSO4溶液中,水的离程度相同 |
| B、在含Al3+的KNO3溶液中,可通过加热法除去Al3+,证明盐的水解是吸热反应 |
| C、已知HF的酸性比HCN的酸性强,则等体积等浓度NaF和NaCN两溶液中阳离子的物质的量之和相等 |
| D、等物质的量浓度的①NH4Cl ②NH4HSO4 ③Na2S ④NaNO3 ⑤(NH4)2SO4,其pH由大到小的排列为③>④>⑤>①>② |
X、Y、Z、W均为短周期主族元素,表中为周期表的一部分.W原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A、通常情况下,X元素只存在两种氧化物 |
| B、Y元素气态氢化物的还原性最强 |
| C、X元素的非金属性比Y元素非金属性强 |
| D、W的最高价氧化物对应水化物的酸性比Z的强 |
下列事实合理,且能用勒夏特列原理解释的是( )
| A、实验室用排饱和食盐水法收集少量氯气 |
| B、对2HI?H2+I2(g)平衡体系增加压强使颜色变深 |
| C、反应CO+NO2?CO2+NO 正反应放热,升高温度使平衡向正方向移动 |
| D、氢能是目前世界上比较理想的能源之一 |
下列有关氧化还原反应的说法中,正确的是( )
| A、NO2溶于水发生了氧化还原反应 |
| B、Na2O2与CO2反应时,Na2O2只作氧化剂 |
| C、SO2使酸性KMnO4溶液褪色,体现了SO2的漂白性 |
| D、浓HNO3与C反应时,体现了HNO3的强氧化性和酸性 |
设NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A、常温常压下,NA个CO2分子的质量总和为44 g |
| B、常温常压下,1mol氦气含有的氦原子为1 NA |
| C、12.4 g 白磷(P4)中含有的磷原子数为0.4 NA |
| D、0.1 mol?L-1稀硫酸100 mL中含硫酸根个数为0.1 NA |

