题目内容
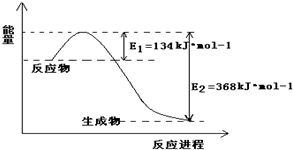 Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式
Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式(2)向上述可逆反应中加入催化剂,则E1(填增大、减小或不变,下同)
Ⅱ.已知90℃时,水的离子积常数为1×10-12.在此温度下,将pH=10的NaOH溶液与pH=4的H2SO4溶液混合,得到pH=7的混合溶液.则NaOH溶液与H2SO4溶液的体积比是
考点:热化学方程式,酸碱混合时的定性判断及有关ph的计算
专题:基本概念与基本理论
分析:Ⅰ、(1)依据图象分析计算反应的焓变=反应物断裂化学键吸收的能量-生成物化学键形成放出的能量,标注物质聚集状态和对应反应焓变写出反应的热化学方程式;
(2)加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量;
Ⅱ、90℃时,水的离子积常数为1×10-12,Kw=c(OH-)×c(H+),PH=6时,溶液呈中性.pH=4的H2SO4溶液,c(H+)=1×10-4mol/L,pH=10的NaOH溶液,根据Kw=c(OH-)×c(H+),c(OH-)=
mol/L=1×10-2mol/L,要使混合液的pH=7,溶液呈碱性,即氢氧化钠过量,混合溶液中氢氧根离子的物质的量浓度=
=10-5 mol/L.据此解答.
(2)加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量;
Ⅱ、90℃时,水的离子积常数为1×10-12,Kw=c(OH-)×c(H+),PH=6时,溶液呈中性.pH=4的H2SO4溶液,c(H+)=1×10-4mol/L,pH=10的NaOH溶液,根据Kw=c(OH-)×c(H+),c(OH-)=
| 1×10 -12 |
| 1×10 -10 |
| 10 -12 |
| 10 -7 |
解答:
解:Ⅰ、(1)依据图象分析计算反应的焓变△H=反应物断裂化学键吸收的能量-生成物化学键形成放出的能量=134KJ/mol-368KJ/mol=-234KJ/mol,
热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(2)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,
故答案为:减小;减小;不变;加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变;
Ⅱ、90℃时,水的离子积常数为1×10-12,Kw=c(OH-)×c(H+),PH=6时,溶液呈中性.
pH=4的H2SO4溶液,c(H+)=1×10-4mol/L,pH=8的NaOH溶液,根据Kw=c(OH-)×c(H+),c(OH-)=
mol/L=1×10-2mol/L,设pH=4的H2SO4溶液XL和pH=10的NaOH溶液YL混合,混合液的pH=7,氢氧化钠过量,混合溶液中氢氧根离子的物质的量浓度=
=10-5 mol/L,两种溶液混合后氢氧化钠的物质的量浓度:
=10-5mol/L,所以X:Y=11:999,
故答案为:11:999.
热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(2)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,
故答案为:减小;减小;不变;加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变;
Ⅱ、90℃时,水的离子积常数为1×10-12,Kw=c(OH-)×c(H+),PH=6时,溶液呈中性.
pH=4的H2SO4溶液,c(H+)=1×10-4mol/L,pH=8的NaOH溶液,根据Kw=c(OH-)×c(H+),c(OH-)=
| 1×10 -12 |
| 1×10 -10 |
| 10 -12 |
| 10 -7 |
| 10 -2Y-10 -4X |
| X+Y |
故答案为:11:999.
点评:本题考查了热化学方程式书写方法,混合溶液PH的计算,难度不大,注意该题中中性溶液的PH不等于7而是为6,能灵活运用水的离子积常数是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
等体积、等浓度的HCOONa和NaCN溶液,溶液中离子总数的关系正确的是(已知HCOOH比HCN易电离)( )
| A、HCOONa=NaCN |
| B、HCOONa>NaCN |
| C、HCOONa<NaCN |
| D、无法确定 |
下列实验现象预测、实验设计、仪器使用能达到目的是( )
A、 模拟工业制氨气并检验产物 |
B、 分离沸点不同的两种液体 |
C、 收集并吸收多余氯气 |
D、 盛放浓硝酸 |
X、Y、Z、W均为短周期主族元素,表中为周期表的一部分.W原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A、通常情况下,X元素只存在两种氧化物 |
| B、Y元素气态氢化物的还原性最强 |
| C、X元素的非金属性比Y元素非金属性强 |
| D、W的最高价氧化物对应水化物的酸性比Z的强 |
下列有关说法正确的是( )
| A、复分解反应一定都属于非氧化还原反应 |
| B、在氧化还原反应中,非金属单质一定是氧化剂 |
| C、某元素从化合物变为单质时,该元素一定被还原 |
| D、金属阳离子被还原一定得到金属单质 |