题目内容
3. 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是BD(填字母).
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol/L的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸进行配制.
②在配制过程中,下列实验操 作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”,填C表示“无影响”).
I.用量筒量取浓盐酸时俯视观察凹液面B
II.转移浓溶液时操作不慎,有一滴液体溅出容量瓶B
III.定容摇匀后,发现液面低于刻度线C
IV.定容时,俯视读数,所得溶液的浓度A.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸中HCl的物质的量浓度;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化;
(3)①根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;
②分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度的影响;
解答 解:(1)该浓盐酸中HCl的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关,
故答案为:BD;
(3)①设需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:V×10-3L×11.9mol/L=0.5 L×0.400mol/L
解得:V=16.8
故答案为:16.8;
②I.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质的物质的量偏小,溶液浓度偏低;
故答案为:B;
II.转移浓溶液时操作不慎,有一滴液体溅出容量瓶,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低;
故答案为:B;
III.定容摇匀后,发现液面低于刻度线,属于正常 操作,溶液浓度准确,不受影响;
故答案为:C;
IV.定容时,俯视读数,所得溶液的浓度,导致溶液体积偏小,溶液浓度浓度偏高;
故答案为:A.
点评 本题考查物质的量浓度计算、一定物质的量浓度溶液配制等,难度不大,注意根据c=$\frac{n}{V}$理解溶液配制原理及进行误差分析.

练习册系列答案
相关题目
13.下列物质中,属于电解质且能导电的是( )
| A. | 石墨 | B. | 硫酸溶液 | C. | 熔融氯化钠 | D. | 固态氯化钾 |
11.(1)已知A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族且A是原子半径最小的元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙为其中的三种,它们的元素组成如表所示:
常温下,甲物质为有剧毒的气体,密度略小于空气;乙物质为液体;丙物质为固体且为离子化合物.
请填写下列空白:甲的化学式为CO,乙的化学式为H2O2,丙的化学式为Na2O2,其中丙中阴离子与阳离子的个数之比为1:2.
(2)工业上常用SO2除去CO,生成物为S和CO2.
已知:S(s)+O2(g)=SO2(g)△H=a kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
则反应SO2(g)+2CO(g)=S (s)+2CO (g) 的△H=(2b-a)kJ/mol
(3)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(4)某同学设计了一个CH3OH燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图:
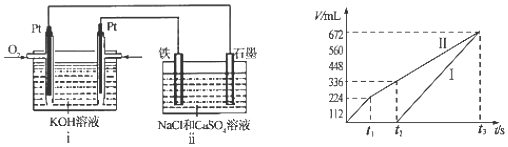
①写出ⅰ装置中通入甲醇这一极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),则曲线I表示阴极电极上的反应情况(填“阴极”或“阳极”).写出在t1后,石墨电极上的电极反应式4OH--4e-=O2↑+2H2O (或2H2O-4e-=O2↑+4H+).
| 化合物 | 甲 | 乙 | 丙 |
| 组成元素 | B、C | A、C | C、D |
请填写下列空白:甲的化学式为CO,乙的化学式为H2O2,丙的化学式为Na2O2,其中丙中阴离子与阳离子的个数之比为1:2.
(2)工业上常用SO2除去CO,生成物为S和CO2.
已知:S(s)+O2(g)=SO2(g)△H=a kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
则反应SO2(g)+2CO(g)=S (s)+2CO (g) 的△H=(2b-a)kJ/mol
(3)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(4)某同学设计了一个CH3OH燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图:

①写出ⅰ装置中通入甲醇这一极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),则曲线I表示阴极电极上的反应情况(填“阴极”或“阳极”).写出在t1后,石墨电极上的电极反应式4OH--4e-=O2↑+2H2O (或2H2O-4e-=O2↑+4H+).
18.下列物质在水溶液中的电离方程式书写正确的是( )
| A. | KClO3═K++3O2-+Cl5+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHS?Na++HS- | D. | HCO3-?H++CO32- |
4.下列关于工业生产的叙述中,不正确的是( )
| A. | 目前工业上主要采用接触法制硫酸,并使用热交换器充分利用反应中放出的热量 | |
| B. | 从海水中提取溴,是将提取粗盐后的母液浓缩、氧化,使溶液中的溴离子发生氧化反应转化成溴单质,就得到粗溴 | |
| C. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| D. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阳离子交换膜 |
5.下列物质中,不属于电解质的是( )
| A. | NaCl | B. | 盐酸 | C. | H2SO4 | D. | KOH |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: ;
;