题目内容
8. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)某学生欲用上述浓盐酸和蒸馏水配制470ml 物质的量浓度为0.500mol•L-1的稀盐酸.
①该学生需要量取500ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填序号A表示“偏大”、填B表示“偏小”、填C表示“无影响”).
I.用量筒量取浓盐酸进俯视观察凹液面A.
II.定容时仰视液面B.
III.用量筒量取所需浓盐酸倒入烧怀后,再用水洗涤盆简2~3次,洗涤液倒入烧杯中A.
分析 (1)依据C=$\frac{1000ω}{M}$计算浓盐酸的物质的量浓度;
(2)①配制470ml,应选比其略大的500ml的容量瓶;
②I.用量筒量取浓盐酸进俯视观察凹液面,体积变小;
II.定容时仰视液面,溶液体积变大;
III.用量筒量取所需浓盐酸倒入烧怀后,再用水洗涤盆简2~3次,洗涤液倒入烧杯中,溶液的物质的量变大.
解答 解:(1)浓盐酸的物质的量浓度C=$\frac{1000ω}{M}$=$\frac{1000×11.9g/ml×36.5%}{36.5g/mol}$=11.9mol/L,故答案为:11.9;
(2)①配制470ml,应选比其略大的500ml的容量瓶,故答案为:500;
②I.用量筒量取浓盐酸进俯视观察凹液面,体积变小,所以浓溶液的物质的量变大,所以稀盐酸的物质的量浓度偏大,故答案为:A;
II.定容时仰视液面,溶液体积变大,所以稀盐酸的物质的量浓度偏小,故答案为:B;
III.用量筒量取所需浓盐酸倒入烧怀后,再用水洗涤盆简2~3次,洗涤液倒入烧杯中,溶液的物质的量变大,所以稀盐酸的物质的量浓度偏大,故答案为:A.
点评 本题考查了配制一定物质的量浓度溶液,题目难度不大,熟悉配制的原理和步骤是解题关键,注意溶液稀释的规律.

练习册系列答案
相关题目
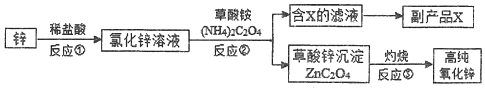
18.为提纯下列物质(括号内为杂质),所用的除杂试剂盒分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4 (C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | NH4Cl溶液 (FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯 (乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | C2H5OH (H2O) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
16.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为( )
| A. | 0.24mol | B. | 0.21mol | C. | 0.25mol | D. | 0.12mol |
20.在一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g),其相关数据如表所示:
(1)T1>T2(填“>”、“<”或“=”)
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正=V逆
(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)═2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
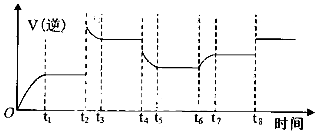
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,(填“t1~t2,以此类推”).
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正=V逆
(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)═2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,(填“t1~t2,以此类推”).
9.饱和氨水溶液中存在化学平衡和电离平衡:NH3+H2O?NH3•H2O?NH4++OH-.下列有关说法正确的是( )
| A. | 常温下饱和氨水的pH<7 | |
| B. | 向氨水中滴加过量硫酸,所有平衡均向正向移动,pH增大 | |
| C. | 电离是吸热反应,升高温度,所有平衡均正向移动 | |
| D. | 向氨水中加入少量NaOH固体,所有平衡均逆向移动,有NH3放出 |
10.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
SiO2$→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000-1100℃}^{③过量H_{2}}$Si(纯)下列说法正确的是( )
SiO2$→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000-1100℃}^{③过量H_{2}}$Si(纯)下列说法正确的是( )
| A. | 步骤①的化学方程式为SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1 mol Si,转移4 mol 电子 | |
| C. | 二氧化硅能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: