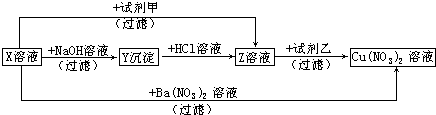
题目内容
5.下列物质中,不属于电解质的是( )| A. | NaCl | B. | 盐酸 | C. | H2SO4 | D. | KOH |
分析 在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质,无论电解质还是非电解质,都一定为化合物,据此进行判断.
解答 解:A、NaCl在溶液中和熔融状态下都能够导电,所以NaCl为电解质,故A错误;
B、盐酸属于混合物,所以盐酸既不是电解质也不是非电解质,故B正确;
C、H2SO4在水溶液下能够导电,是电解质,故C错误;
D、KOH在水溶液和熔融状态下都能够导电,KOH为电解质,故D错误;
故选B.
点评 本题考查了电解质与非电解质的判断,题目难度不大,注意明确电解质与非电解质、强电解质与弱电解质的概念,特别注意:不是电解质的物质不一定属于非电解质.

练习册系列答案
相关题目
13.下列实验目的无法实现的是( )
| A. | 用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 | |
| B. | 用KSCN溶液鉴别Fe3+和Fe2+ | |
| C. | 用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+ | |
| D. | 在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
10.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
SiO2$→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000-1100℃}^{③过量H_{2}}$Si(纯)下列说法正确的是( )
SiO2$→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000-1100℃}^{③过量H_{2}}$Si(纯)下列说法正确的是( )
| A. | 步骤①的化学方程式为SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1 mol Si,转移4 mol 电子 | |
| C. | 二氧化硅能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
17.常温下,有体积均为10mL、pH均等于1的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 上述两种溶液分别用水稀释m、n倍,溶液的pH都变成3,则m>n | |
| B. | 上述两种溶液分别与足量的Zn完全反应,产生的H2一样多 | |
| C. | 上述两种溶液分别与等浓度的氢氧化钠溶液恰好反应,消耗氢氧化钠溶液的体积相同 | |
| D. | 1mol/L的盐酸和1mol/L的醋酸的混合溶液与氢氧化钠溶液恰好完全反应时,反应后溶液中c(CH3COO-)+C(Cl-)<c(Na+) |
14.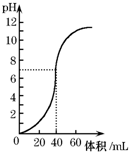 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A. | 1mol•L-1,60mL | B. | 0.5mol•L-1,80mL | C. | 0.5mol•L-1,40mL | D. | 1mol•L-1.80mL |
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: