题目内容
5.表为周期表的一部分,其中的编号代表对应不同的元素.
请回答下列问题.
(1)表中属于d区的元素是⑨(填编号);元素⑧的原子价电子排布式是3d104s1.
(2)③和⑦形成的常见化合物的晶体类型是分子晶体立体构型是三角锥形中心原子杂化方式sp3
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的③(填编号);该元素与元素①形成的化合物X极易溶于水的原因是氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键.
(4)②③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为C3N4,其熔点比金刚石的高(填“高”或“低”).
(5)⑤的氧化物与⑥的最高价氧化物的水化物的离子反应的方程式为Al2O3+6H+═2Al3++3H2O.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe
(1)d区元素包含周期表中3-10列元素;元素⑧位于第四周IB族;
(2)N和Cl形成的常见化合物有NCl3,为分子晶体;与NH3分子相似,空间构型为三角锥形;中心原子杂化方式为sp3
(3)s能级最多容纳2个电子,且p能级容纳电子,故n=2,则该元素为N元素,氨气和水都是极性分子,相似相溶原理,又由于氨分子与水分子间可形成氢键;
(4)C、N形成的化合物为C3N4,由其超硬,耐高温等性质,可判断该化合物属于原子晶体,由于C-N键比C-C键短,C-N键键能更大,其熔点更高;
(5)Al的氧化物为Al2O3,S的最高价氧化物的水化物为H2SO4,二者反应生成硫酸铝与水.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe
(1)属于d区的是Fe为⑨号元素,⑧为Cu元素,位于第四周IB族,Cu的外围电子排布为3d104s1,故答案为:Fe;3d104s1;
(2)N和Cl形成的常见化合物有NCl3,为分子晶体;与NH3分子相似,空间构型为三角锥形;中心原子杂化方式为sp3,故答案为:分子晶体;三角锥形;sp3;
(3)s能级最多容纳2个电子,且p能级容纳电子,故n=2,则该元素为N元素,即为③号元素,氨气和水都是极性分子,根据相似相溶原理可知NH3易溶于水,又由于氨分子与水分子间可形成氢键,使NH3更易溶于水,故答案为:③;氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键;
(4)C、N形成的化合物为C3N4,由其超硬,耐高温等性质,可判断该化合物属于原子晶体,由于C-N键比C-C键短,C-N键键能更大,C3N4熔点更高,故答案为:C3N4;高;
(5)Al的氧化物为Al2O3,S的最高价氧化物的水化物为H2SO4,二者反应的方程式为:Al2O3+6H+═2Al3++3H2O,故答案为:Al2O3+6H+═2Al3++3H2O.
点评 本题考查元素周期表与元素周期律、分子结构与性质、晶体类型与性质等,需要学生熟练掌握元素周期表的结构,侧重考查学生对知识的迁移应用,难度中等

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 1gH2 | B. | 11gCO2 | C. | 8gO2 | D. | 4.5gH2O(g) |
| A. | 维生素是生物生长发育和新陈代谢所必需的物质 | |
| B. | 按溶解性的不同,维生素可分为脂溶性维生素和水溶性维生素两类 | |
| C. | 缺乏维生素A易患甲状腺肿大 | |
| D. | 缺乏维生素C易患坏血病 |
| A. | 为防止Fe2+水解,Fe(NO3)2溶液需要加酸酸化 | |
| B. | 该反应中氧化剂与还原剂物质的量之比为8:1 | |
| C. | 若有1molNO3-发生氧化反应,则转移电子5mol | |
| D. | 该反应中Fe2+是还原剂,NH4+是还原产物 |
| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |

| A. | 1 mol莽草酸完全燃烧消耗156.8 L O2 | |
| B. | 1 mol莽草酸最多与4 mol Na发生反应 | |
| C. | 莽草酸能使溴的四氯化碳溶液褪色 | |
| D. | 莽草酸可发生聚合反应 |
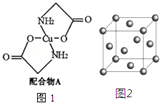 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示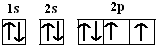 .
.