题目内容
10.标准状况下,密度为0.75g•L-1的NH3与CH4组成的混合气体中,NH3的体积分数为80%.分析 根据M=ρVm计算出混合气体的平均摩尔质量,然后设出氨气和甲烷的物质的量,根据平均摩尔质量列式计算,最后根据相同条件下气体体积之比等于物质的量之比计算出氨气的体积分数.
解答 解:标准状况下,密度为0.75g•L-1的NH3与CH4组成的混合气体的平均摩尔质量为:M=0.75g•L-1×22.4L/mol=16.8g/mol,
设混合气体中NH3、CH4的物质的量分别为x、y,则:$\frac{17x+16y}{x+y}$=16.8,整理可得:x:y=4:1,
相同条件下气体体积之比等于物质的量之比,则混合气体中NH3的体积分数为:$\frac{4}{4+1}$×100%=80%,
故答案为:80%.
点评 本题考查了物质的量的计算,题目难度不大,明确密度与摩尔质量的关系为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
18.NaH是-种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气.下列有关NaH的叙述错误的是( )
| A. | 跟水反应时,水作氧化剂 | B. | NaH在水中显酸性 | ||
| C. | 跟液氨反应时,有NaNH2生成 | D. | 跟乙醇反应时,NaH被氧化 |
5.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- | |
| B. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| C. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
15.下列说法正确的是( )
| A. | 小苏打溶液和NaAlO2溶液反应可以产生沉淀和气体,可以用作泡沫灭火器成分 | |
| B. | 侯德榜制碱过程涉及溶解度差异的原理,工业上从铝土矿制备较高纯度Al2O3的主要工艺流程中使用到CO2气体 | |
| C. | 一定条件下,Na、Mg、Fe都能和水反应生成对应的碱和氢气,Na2O2、MgO、Fe3O4都是碱性氧化物 | |
| D. | 纳米Fe、纳米Cu的化学活性都比原来增强,两者都能与盐酸反应生成氢气 |
2.容量瓶上需标有以下5项中的哪些内容?①温度 ②浓度 ③容量 ④压强 ⑤刻度线( )
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②④ | D. | ②③④ |
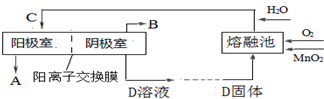
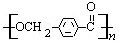 的路线:
的路线: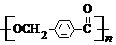
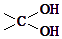 →
→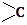 ═O+H2O
═O+H2O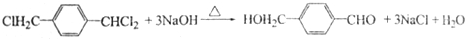 ;该反应过程中生成的不稳定中间体的结构简式应是
;该反应过程中生成的不稳定中间体的结构简式应是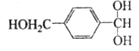 .
.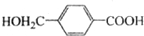 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式:
,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式: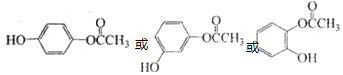 .
. ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.