题目内容
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
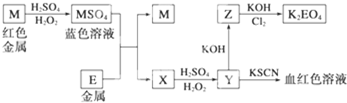
(1)写出M溶于稀硫酸和H2O2混合液的化学方程式为 .
(2)某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色.写出与上述变化过程相关的离子方程式为 .
(3)写出Cl2将Z氧化为K2EO4的化学方程式为 .当有标准状况下3.36L氯气参与反应时,生成K2EO4的质量为 .

(1)写出M溶于稀硫酸和H2O2混合液的化学方程式为
(2)某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色.写出与上述变化过程相关的离子方程式为
(3)写出Cl2将Z氧化为K2EO4的化学方程式为
考点:无机物的推断
专题:推断题
分析:红色金属M为Cu,与硫酸、过氧化氢反应得到CuSO4,Y与KSCN反应得到血红色溶液,则Y含有Fe3+,结合转化关系,根据元素守恒可知,金属E为Fe,则X为FeSO4,Y为Fe2(SO4)3,Z为Fe(OH)3,氢氧化铁与氯气、KOH反应得到K2FeO4,根据电子转移守恒、原子守恒可知,还生成KCl、H2O,据此解答.
解答:
解:红色金属M为Cu,与硫酸、过氧化氢反应得到CuSO4,Y与KSCN反应得到血红色溶液,则Y含有Fe3+,结合转化关系,根据元素守恒可知,金属E为Fe,则X为FeSO4,Y为Fe2(SO4)3,Z为Fe(OH)3,氢氧化铁与氯气、KOH反应得到K2FeO4,根据电子转移守恒、原子守恒可知,还生成KCl、H2O,
(1)Cu溶于稀硫酸和H2O2混合液生成硫酸铜,根据单质转移守恒与原子守恒可知,还有水生成,反应方程式为:Cu+H2O2+H2SO4═CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4═CuSO4+2H2O;
(2)亚铁离子被氧气氧化为铁离子,铁离子氧化碘离子生成碘单质,碘遇淀粉变为蓝色,反应涉及的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O、2Fe3++2I-═2Fe2++I2,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O、2Fe3++2I-═2Fe2++I2;
(3)Cl2将Fe(OH)3氧化为K2FeO4的化学方程式为:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O,标准状况下3.36L氯气参与反应,其物质的量=
=0.15mol,由方程式可知,生成K2FeO4的物质的量=0.15mol×
=0.1mol,故生成K2FeO4的质量=0.1mol×198g/mol=19.8g,
故答案为:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O;19.8g.
(1)Cu溶于稀硫酸和H2O2混合液生成硫酸铜,根据单质转移守恒与原子守恒可知,还有水生成,反应方程式为:Cu+H2O2+H2SO4═CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4═CuSO4+2H2O;
(2)亚铁离子被氧气氧化为铁离子,铁离子氧化碘离子生成碘单质,碘遇淀粉变为蓝色,反应涉及的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O、2Fe3++2I-═2Fe2++I2,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O、2Fe3++2I-═2Fe2++I2;
(3)Cl2将Fe(OH)3氧化为K2FeO4的化学方程式为:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O,标准状况下3.36L氯气参与反应,其物质的量=
| 3.36L |
| 22.4L/mol |
| 2 |
| 3 |
故答案为:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O;19.8g.
点评:本题考查无机物推断,物质的颜色是推断突破口,(2)注意亚铁离子不稳定,易被氧化为铁离子,难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、10 L pH=1的硫酸溶液中含有的H+数为2NA |
D、0.5 mol雄黄(As4S4,结构如右图)含有NA个S-S键 |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、向盐酸中滴加氨水的过程,可能满足c(H+)>c(NH4+) |
| B、0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、等浓度的NaClO、NaHCO3混合溶液中:c(Na+)=c(ClO?)+c(HClO)+c(HCO3-)+c(H2CO3)+c(CO32-) |
| D、浓度均为0.1mol/L的HA(一元弱酸)和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
将如图所示实验装置的K闭合,下列判断错误的是( )
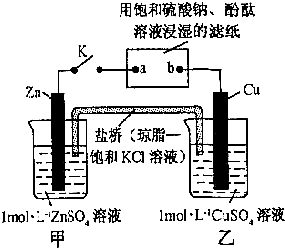

| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
 硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
 ═□Mn2++□NO
═□Mn2++□NO