题目内容
从物质A的水溶液出发,有如图所示的一系列变化(参加反应或反应生成的H2O没有表示出来).
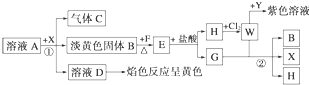
试完成下列问题:
(1)写出下列物质的化学式:A ,E ,X ,Y .
(2)写出步骤①②发生反应的离子方程式:① ;② .

试完成下列问题:
(1)写出下列物质的化学式:A
(2)写出步骤①②发生反应的离子方程式:①
考点:无机物的推断
专题:推断题
分析:“H+Cl2→W
紫色溶液”,可知“H+Cl2→W”为化合反应,并且考虑到三价铁离子遇苯酚溶液显紫色.联想到常见的反应:2FeCl2+Cl2═2FeCl3,可知H为FeCl2,W为FeCl3,Y为苯酚.由G+W(FeCl3)→B(淡黄色固体)+X+H(FeCl2)知,G为还原剂,固体B为反应后的生成物,可联想到H2S与FeCl3的反应,从而断定G为H2S,B为S,X为HCl.“B+F
E
H(FeCl2)+G(H2S)”中的F为Fe,E为FeS.“A+X(HCl)→B+C(气体)+D”,溶液D焰色反应为黄色,含有Na元素,可推知A为Na2S2O3,C为SO2,D为NaCl.
| +Y |
| △ |
| +盐酸 |
解答:
解:“H+Cl2→W
紫色溶液”,可知“H+Cl2→W”为化合反应,并且考虑到三价铁离子遇苯酚溶液显紫色.联想到常见的反应:2FeCl2+Cl2═2FeCl3,可知H为FeCl2,W为FeCl3,Y为苯酚.由G+W(FeCl3)→B(淡黄色固体)+X+H(FeCl2)知,G为还原剂,固体B为反应后的生成物,可联想到H2S与FeCl3的反应,从而断定G为H2S,B为S,X为HCl.“B+F
E
H(FeCl2)+G(H2S)”中的F为Fe,E为FeS.“A+X(HCl)→B+C(气体)+D”,溶液D焰色反应为黄色,含有Na元素,可推知A为Na2S2O3,C为SO2,D为NaCl,
(1)由上述分析可知,A为Na2S2O3,E为FeS,X为HCl,Y为C6H5OH,
故答案为:Na2S2O3;FeS;HCl;C6H5OH;
(2)反应①的离子方程式为S2O32-+2H+═S↓+SO2↑+H2O,
反应②的离子方程式为2Fe3++H2S═2Fe2++S↓+2H+,
故答案为:S2O32-+2H+═S↓+SO2↑+H2O;2Fe3++H2S═2Fe2++S↓+2H+.
| +Y |
| △ |
| +盐酸 |
(1)由上述分析可知,A为Na2S2O3,E为FeS,X为HCl,Y为C6H5OH,
故答案为:Na2S2O3;FeS;HCl;C6H5OH;
(2)反应①的离子方程式为S2O32-+2H+═S↓+SO2↑+H2O,
反应②的离子方程式为2Fe3++H2S═2Fe2++S↓+2H+,
故答案为:S2O32-+2H+═S↓+SO2↑+H2O;2Fe3++H2S═2Fe2++S↓+2H+.
点评:本题考查无机物推断,题目没有明显的突破口,需要学生熟练掌握基础知识,属于猜测验证型推断,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
CH4、C2H4、C2H2,分别在足量O2中完全燃烧,以下说法不正确的是( )
| A、等物质的量时CH4、C2H4燃烧生成的H2O一样多 |
| B、等质量时C2H2燃烧生成的CO2最多 |
| C、等物质的量时C2H2燃烧耗氧最少 |
| D、等质量时CH4燃烧耗氧最多 |
在3Cl2+6KOH═KClO3+5KCl+3H2O中,还原产物和氧化产物的物质的量之比( )
| A、1:5 | B、1:3 |
| C、5:1 | D、3:1 |
下列选项属于模型的是( )
| A、H2O |
| B、表示方向的指向标 |
| C、电流I |
| D、沙盘中的校园 |