题目内容
将如图所示实验装置的K闭合,下列判断错误的是( )
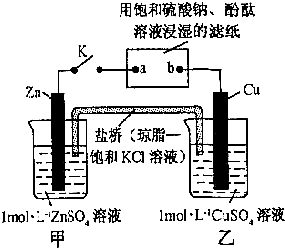

| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:K闭合,甲、乙能自发进行氧化还原反应而组成原电池,锌易失电子作负极,铜作正极,则a电极是阴极、b电极是阳极,阳极上氢氧根离子放电,阴极上氢离子放电生成氢气,原电池放电时,盐桥中阴离子向负极区域移动,电子从负极沿导线流向阴极,从阳极流向正极.
解答:
解:A.铜电极是正极,正极上铜离子得电子发生还原反应,故A正确;
B.电子从Zn→a,b→Cu路径流动,故B错误;
C.盐桥中氯离子向负极锌电极区域移动,故C正确;
D.a点是阴极,阴极上氢离子放电,同时电极附近有氢氧根离子生成,导致a电极附近溶液碱性增强,则滤纸a点变红色,故D正确;
故选B.
B.电子从Zn→a,b→Cu路径流动,故B错误;
C.盐桥中氯离子向负极锌电极区域移动,故C正确;
D.a点是阴极,阴极上氢离子放电,同时电极附近有氢氧根离子生成,导致a电极附近溶液碱性增强,则滤纸a点变红色,故D正确;
故选B.
点评:本题考查了原电池和电解池原理,明确电极反应的自发性确定正负极,再结合阴阳极上发生的电极反应来分析解答,易错选项是B,注意:电子不进入电解质溶液,电解质溶液中阴阳离子定向移动形成电流,为易错点.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列说法中正确的是( )
A、碳酸氢钠溶液中:c(Na+)>c(HCO
| ||||
B、常温下氨水与(NH4)2SO4溶液混合后,若溶液中c(NH4+):c(SO
| ||||
| C、硫酸铜、硫酸铝溶液与硫化钠溶液混合,都会生成氢氧化物沉淀 | ||||
| D、配制氯化铁溶液时,往往加入少量稀盐酸,并加入少量铁粉 |
铅蓄电池广泛应用于机动车辆,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和氯化镁溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
| A、蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电解池的阴极反应式为:2H++2e-=H2↑ |
| C、电解过程中溶液中会产生白色沉淀现象 |
| D、蓄电池中每生成1molH2O,电解池中就消耗1molH2O |
某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A、反应在前5s的平均速率v(A)=0.17mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,则反应的△H>0 |
| C、相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% |
| D、相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,反应达到平衡前v(正)<v(逆) |
一氧化碳是一种用途相当广泛的化工基础原料.利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍. Ni(s)+4CO(g)?Ni(CO)4(g)在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表,下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
| A、上述反应是熵增反应 |
| B、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol?L-1,则此时v(正)<v(逆) |
| C、25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 |
| D、恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO的百分含量将增大 |
下列离子方程式正确的是( )
| A、碳酸氢钠溶液与过量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl- |
| C、1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,7.1g Cl2和足量的NaOH反应,转移电子数0.2NA |
| B、标准状况下,11.2L氩气含原子数NA |
| C、32g O2和O3混合气体含氧原子数2NA |
| D、18g H2O和18g D2O所含电子数均为10NA |

