题目内容
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
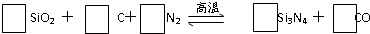
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)反应中每产生6.72L(标准状况)CO气体,破坏 π 键的数目为 ;
(3)Si 价电子排布式为 ;
(4)已知Si的电负性为1.8,H的电负性为2.1,N的电负性为3.0,则SiH4 中氢的化合价为 ,Si3N4所属的化合物类型是 (填“离子化合物”或“共价化合物”).
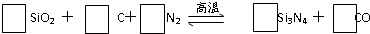
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)反应中每产生6.72L(标准状况)CO气体,破坏 π 键的数目为
(3)Si 价电子排布式为
(4)已知Si的电负性为1.8,H的电负性为2.1,N的电负性为3.0,则SiH4 中氢的化合价为
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:(1)根据氧化还原反应化合价升降总数相等以及质量守恒来解答;
(2)n(CO)=
=0.3mol;计算消耗N2的物质的量,结合1个N2分子中含有2个π 键计算;
(3)Si最外层(M层)有4个电子;
(4)电负性较强的吸电子能力强,结合化合价代数和为0计算,Si3N4为共价化合物.
(2)n(CO)=
| 6.72L |
| 22.4L/mol |
(3)Si最外层(M层)有4个电子;
(4)电负性较强的吸电子能力强,结合化合价代数和为0计算,Si3N4为共价化合物.
解答:
解:(1)Si的化合价前后未变,N的化合价由0降为-3,C的化合价由0升为+2,生成1个Si3N4化合价降低12,生成1个CO化合价升高2,根据化合价升降总数相等以及质量守恒得3SiO2+6C+2N2
Si3N4+6CO,
故答案为:3;6;2;1;6;
(2)n(CO)=
=0.3mol,由方程式可知消耗N2的物质的量为0.1mol,1个N2分子中含有2个π 键,则破坏 π 键的数目为0.2NA,
故答案为:0.2NA;
(3)Si最外层(M层)有4个电子,Si 价电子排布式为3s23p2,故答案为:3s23p2;
(4)电负性较强的吸电子能力强,SiH4 中氢的化合价为-1价,Si3N4所属的化合物类型是共价化合物,故答案为:-1;共价化合物.
| ||
故答案为:3;6;2;1;6;
(2)n(CO)=
| 6.72L |
| 22.4L/mol |
故答案为:0.2NA;
(3)Si最外层(M层)有4个电子,Si 价电子排布式为3s23p2,故答案为:3s23p2;
(4)电负性较强的吸电子能力强,SiH4 中氢的化合价为-1价,Si3N4所属的化合物类型是共价化合物,故答案为:-1;共价化合物.
点评:本题考查学生有关氧化还原反应中的有关概念、配平,电子转移等,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
下列甲组、乙组中的两种试剂分别混合,甲组能产生气体,乙组气体会被大量吸收的是( )
| A、甲:过氧化钠和水,乙:浓氨水和SO2 |
| B、甲:浓盐酸和MnO2,乙:BaCl2溶液和SO2 |
| C、甲:冷的浓硫酸和铝,乙:NaOH溶液和Cl2 |
| D、甲:浓硫酸和蔗糖(滴有几滴水),乙:H2SO4溶液和氨气 |
下列叙述正确的是( )
| A、某液体物质的摩尔质量大于18 g?mol-1,则该物质密度一定比水大 |
| B、c mol?L-1 KCl溶液的密度为ρg/cm3,则此KCl溶液的质量分数为74.5c÷1000ρ×100% |
| C、将90% H2SO4溶液与10% H2SO4溶液等体积混合,其质量分数一定等于50% |
| D、同温同压下,分别将充满HCl、NO2的两支试管倒立于蒸馏水中足够长时间,假设不考虑溶质扩散,两支试管中溶液的物质的量浓度之比为3:2 |
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1molCl2发生反应时,转移的电子数一定为2NA |
| B、1.7g H2O2中含有的电子数为0.9 NA |
| C、1mol Na2O2 固体中含离子总数为4 NA |
| D、标准状况下,2.24L苯所含分子数为0.1NA |