题目内容
 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:①X与Z、Y与W分别同主族;
②X、Z、W分别与Y都能形成两种常见的化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同,
试根据以上叙述填空.
(1)写出由Y与Z形成的化合物Z2Y2的电子式
(2)写出由X、Z、W三种元素组成的盐溶于水呈碱性的离子方程式
(3)写出均由这4种元素组成的两种化合物在水溶液中发生反应的离子方程式
(4)X、Y两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电.
①b是电池的
②a电极上的电极反应式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数依次增大的4种短周期元素X、Y、Z、W,X与Z、Y与W分别同主族;X、Z、W分别与Y都能形成两种常见的化合物,可推知Y为O、W为S;Y的阴离子与Z的阳离子的核外电子排布相同,则Z为Na,故X为H,
(1)Na2O2属于离子化合物,过氧根离子中O原子之间形成1对共用电子对且满足8电子结构;
(2)由H、Na、S三种元素组成的盐为NaHS,溶液中HS-水解,破坏水的电离平衡,溶液呈碱性;
(3)由上述4种元素组成的两种化合物为NaHSO3、NaHSO4,在水溶液中亚硫酸氢根与氢离子反应生成二氧化硫与水;
(4)氢气、氧气碱性燃料电池中,氢气发生氧化反应、氧气发生还原反应,由图可知,a极通入氢气,为原电池的负极,b极通入氧气,为原电池正极,氢气在负极上失去电子,碱性条件下生成水.
(1)Na2O2属于离子化合物,过氧根离子中O原子之间形成1对共用电子对且满足8电子结构;
(2)由H、Na、S三种元素组成的盐为NaHS,溶液中HS-水解,破坏水的电离平衡,溶液呈碱性;
(3)由上述4种元素组成的两种化合物为NaHSO3、NaHSO4,在水溶液中亚硫酸氢根与氢离子反应生成二氧化硫与水;
(4)氢气、氧气碱性燃料电池中,氢气发生氧化反应、氧气发生还原反应,由图可知,a极通入氢气,为原电池的负极,b极通入氧气,为原电池正极,氢气在负极上失去电子,碱性条件下生成水.
解答:
解:原子序数依次增大的4种短周期元素X、Y、Z、W,X与Z、Y与W分别同主族;X、Z、W分别与Y都能形成两种常见的化合物,可推知Y为O、W为S;Y的阴离子与Z的阳离子的核外电子排布相同,则Z为Na,故X为H,
(1)Na2O2属于离子化合物,过氧根离子中O原子之间形成1对共用电子对且满足8电子结构,其电子式为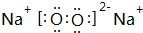 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(2)由H、Na、S三种元素组成的盐为NaHS,溶液中HS-水解:HS-+H2O?H2S+OH-,破坏水的电离平衡,溶液呈碱性,故答案为:HS-+H2O?H2S+OH-;
(3)由上述4种元素组成的两种化合物为NaHSO3、NaHSO4,在水溶液中亚硫酸氢根与氢离子反应生成二氧化硫与水,反应离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(4)①氢气、氧气碱性燃料电池中,氧气发生还原反应,由图可知,b极通入氧气,为原电池正极,故答案为:正;
②氢气发生氧化反应,由图可知,a极通入氢气,为原电池的负极,氢气在负极上失去电子,碱性条件下生成水,电极反应式为H2+2OH-+2e-=2H2O,
故答案为:正;H2+2OH-+2e-=2H2O.
(1)Na2O2属于离子化合物,过氧根离子中O原子之间形成1对共用电子对且满足8电子结构,其电子式为
 ,含有离子键、共价键,
,含有离子键、共价键,故答案为:
 ;离子键、共价键;
;离子键、共价键;(2)由H、Na、S三种元素组成的盐为NaHS,溶液中HS-水解:HS-+H2O?H2S+OH-,破坏水的电离平衡,溶液呈碱性,故答案为:HS-+H2O?H2S+OH-;
(3)由上述4种元素组成的两种化合物为NaHSO3、NaHSO4,在水溶液中亚硫酸氢根与氢离子反应生成二氧化硫与水,反应离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(4)①氢气、氧气碱性燃料电池中,氧气发生还原反应,由图可知,b极通入氧气,为原电池正极,故答案为:正;
②氢气发生氧化反应,由图可知,a极通入氢气,为原电池的负极,氢气在负极上失去电子,碱性条件下生成水,电极反应式为H2+2OH-+2e-=2H2O,
故答案为:正;H2+2OH-+2e-=2H2O.
点评:本题考查结构性质位置关系应用,涉及常用化学用语、化学键、元素化合物推断、原电池等,难度中等,(4)中注意掌握电极的判断与电极反应式的书写.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
以下物质的分子可用比例模型 表示的是( )
表示的是( )
 表示的是( )
表示的是( )| A、CO2 |
| B、H2O |
| C、N2O |
| D、HClO |
若阿伏加德罗常数的数值为NA,则下列说法中正确的是( )
| A、1.0L 0.1 mol?L-1Na2S溶液中含有的S2-离子数小于0.1NA |
| B、1 mol氯气与过量的Fe反应,转移电子的数目为2 NA |
| C、2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| D、50mL18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
物质的量浓度各为0.1mol/L的CH3COOH和CH3COONa溶液等体积混合后,溶液呈酸性.下列关系式不正确的是( )
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(CH3COOH)+c(CH3COO-)=0.1 mol/L |
| C、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |

 大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验: 如图为Zn-Cu原电池的示意图,请回答:
如图为Zn-Cu原电池的示意图,请回答: