题目内容
实验室欲用FeSO4.7H2O固体配制FeSO41.0mol/L的溶液240mL:
(1)配制溶液时必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒、胶头滴管 .
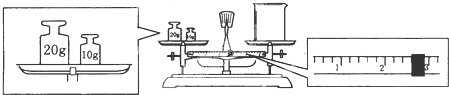
(2)某同学欲称量FeSO4. 7H2O的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图. 烧杯的实际质量为 g;要完成本实验该同学应称出FeSO4.7H2O的质量 g.
(3)容量瓶使用前必须进行的操作为
(4)在配制过程中,其它操作都是正确的,下列操作会引起所配浓度偏高的是 .
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
(1)配制溶液时必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒、胶头滴管
(2)某同学欲称量FeSO4. 7H2O的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图. 烧杯的实际质量为
(3)容量瓶使用前必须进行的操作为
(4)在配制过程中,其它操作都是正确的,下列操作会引起所配浓度偏高的是
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线

考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据实验具体操作步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等来选择实验所需仪器;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,据此计算;根据n=cv计算溶质FeSO4的物质的量,利用FeSO4?7H2O的物质的量等于FeSO4的物质的量,根据m=nM计算FeSO4?7H2O的质量;
(3)容量瓶使用前必须进行的操作为检查容量瓶是否漏水;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
进行误差分析;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,据此计算;根据n=cv计算溶质FeSO4的物质的量,利用FeSO4?7H2O的物质的量等于FeSO4的物质的量,根据m=nM计算FeSO4?7H2O的质量;
(3)容量瓶使用前必须进行的操作为检查容量瓶是否漏水;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
| n |
| V |
解答:
解:(1)配制FeSO41.0mol/L的溶液240mL,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中(实验室没有240mL规格的容量瓶),并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以必须用到的仪器还有250mL容量瓶,
故答案为:250ml容量瓶;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得FeSO4?7H2O的质量为30g-2.6g=27.4g,因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,FeSO4的物质的量n=cV=0.25L×1mol?L-1=0.25mol,FeSO4?7H2O的物质的量等于FeSO4的物质的量,所以FeSO4?7H2O的质量0.25mol×278g/mol=69.5g;
故答案为:27.4g;69.5;
(3)使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,
故答案是:查漏;
(4)①没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液的浓度偏低,故①不选;
②转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,溶液的浓度偏低,故②不选;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故③不选;
④定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,故④选;
⑤定容后塞上瓶塞反复摇匀静置后,液面低于刻度线是正常的,再加水至刻度线则浓度偏小,故⑤不选;
故选④;
故答案为:250ml容量瓶;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得FeSO4?7H2O的质量为30g-2.6g=27.4g,因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,FeSO4的物质的量n=cV=0.25L×1mol?L-1=0.25mol,FeSO4?7H2O的物质的量等于FeSO4的物质的量,所以FeSO4?7H2O的质量0.25mol×278g/mol=69.5g;
故答案为:27.4g;69.5;
(3)使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,
故答案是:查漏;
(4)①没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液的浓度偏低,故①不选;
②转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,溶液的浓度偏低,故②不选;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故③不选;
④定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,故④选;
⑤定容后塞上瓶塞反复摇匀静置后,液面低于刻度线是正常的,再加水至刻度线则浓度偏小,故⑤不选;
故选④;
点评:本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4 L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
稀释某弱酸HA溶液时,浓度增大的是( )
| A、HA |
| B、H+ |
| C、A- |
| D、OH- |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是( )
| A、海水中含有溴元素,需经过化学变化才可以得到溴单质 | ||||||||
| B、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 | ||||||||
| C、从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 | ||||||||
D、从海水中提取镁可以采用下列方法:海水海水
|
下列有关实验原理或实验操作正确的是( )
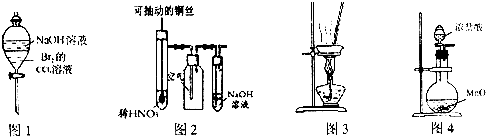

| A、图1装置可以用于除去溶解在CCl4中的Br2 |
| B、图2所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| C、用图3装置在蒸发皿中灼烧CuSO4?5H2O晶体以除去结晶水 |
| D、实验室常用图4装置制取少量氯气 |