题目内容
 已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.
已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.请回答下列问题:
(1)A代表的元素符号为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
(4)BD2在高温高压下所形成的晶体具有很高的熔点和硬度,其晶胞如图所示.该晶体的类型属于
(5)1molB2A2分子中含σ键的数目是
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D、E五种短周期元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;
D原子最外层电子数是次外层的3倍,则D原子电子排布式为1s22s22p4,所以D为氧元素;
B、C、D原子序数依次增大,故C为氮元素;
原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;
E原子的电子层数是A的3倍,E原子的最外层电子数均等于其周期序数,E位于第三周期,为铝元素,据此解答各小题即可.
D原子最外层电子数是次外层的3倍,则D原子电子排布式为1s22s22p4,所以D为氧元素;
B、C、D原子序数依次增大,故C为氮元素;
原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;
E原子的电子层数是A的3倍,E原子的最外层电子数均等于其周期序数,E位于第三周期,为铝元素,据此解答各小题即可.
解答:
解:依据分析可知:A为氢,B为碳,C为氮,D为氧,E为铝,
(1)A为氢,B为碳,元素符号分别为:H、C,故答案为:H;C;
(2)元素的非金属性越强,其第一电离能越大,但是由于N的p轨道处于半充满状态,故N的第一电离能大于O,即C、N、O的第一电离能从小到大为:C<O<N,故答案为:C、O、N;
(3)元素的非金属性越强,电负性越大,由于F的非金属性强于O,故电负性F>O,故答案为:<;
(4)BD2是CO2,由晶体结构图可知,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子配位数是2,故答案为:原子;2;
(5)B2A2为C2H2,C2H2的结构式为H-C≡CH,单键为δ键,三键含有1个δ键、2个π键,1个C2H2分子中含有3个δ键,所以l molC2H2分子中含σ键的数目是3 NA(或1.806×1024)故答案为:3 NA(或1.806×1024).
(1)A为氢,B为碳,元素符号分别为:H、C,故答案为:H;C;
(2)元素的非金属性越强,其第一电离能越大,但是由于N的p轨道处于半充满状态,故N的第一电离能大于O,即C、N、O的第一电离能从小到大为:C<O<N,故答案为:C、O、N;
(3)元素的非金属性越强,电负性越大,由于F的非金属性强于O,故电负性F>O,故答案为:<;
(4)BD2是CO2,由晶体结构图可知,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子配位数是2,故答案为:原子;2;
(5)B2A2为C2H2,C2H2的结构式为H-C≡CH,单键为δ键,三键含有1个δ键、2个π键,1个C2H2分子中含有3个δ键,所以l molC2H2分子中含σ键的数目是3 NA(或1.806×1024)故答案为:3 NA(或1.806×1024).
点评:本题以元素推断为载体,考查原子结构、电负性、电离能、化学键与晶体结构,是对所学知识的综合考查与运用,难度不大,根据结构推断元素是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列热化学方程式中的反应热表示燃烧热的是( )
| A、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);△H=-akJ?mol-1 | ||||
B、CH3CH2OH(l)+
| ||||
C、C(s)+
| ||||
D、NH3(g)+
|
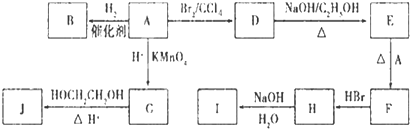
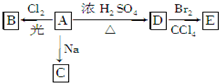 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.