题目内容
 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5.请回答下列问题(用相应的元素符号、化学式和化学术语填空)
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5.请回答下列问题(用相应的元素符号、化学式和化学术语填空)(1)G在周期表中的位置是
(2)BD2分子的电子式为
(3)A元素分别与B、D元素形成的两种微粒H、I都具有N2H4相似的结构,属于等电子数微粒,它们的化学式分别是H:
(4)向G的硫酸盐溶液中逐滴加入足量的氨水至得到的沉淀完全溶解,再向该溶液中加入一定量乙醇,析出一种深蓝色晶体.在该晶体中存在的化学键的种类有
(5)0.3g H在足量氧气中燃烧,生成气态CO2和液态H2O,放出Q kJ热量,则表示H的燃烧热的热化学方程式为
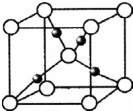
(6)G的一种氧化物的晶胞结构如图所示(黑球代表G原子),该氧化物的化学式为
考点:位置结构性质的相互关系应用
专题:
分析:A是原子半径最小的元素,所以A是氢元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,C、E为短周期元素,且它们原子序数增大,所以C在第二周期第ⅤA族,E在第三周期第ⅡA族,所以C是氮元素,E是镁元素,B、C、D是紧邻的三个族的元素,B、C、D原子序数依次增大,所以B是碳元素,D是氧元素,F是第四周期元素且基态原子具有六个成单电子,则F的价电子排布为3d54s1是24号元素,铬元素,G的核电荷数比F多5,所以G是铜元素,故A是H、B是C、C是N、D是O、E是Mg、F是Cr、G是Cu,据此解答各题即可.
解答:
解:A是原子半径最小的元素,所以A是氢元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,C、E为短周期元素,且它们原子序数增大,所以C在第二周期第ⅤA族,E在第三周期第ⅡA族,所以C是氮元素,E是镁元素,B、C、D是紧邻的三个族的元素,B、C、D原子序数依次增大,所以B是碳元素,D是氧元素,F是第四周期元素且基态原子具有六个成单电子,则F的价电子排布为3d54s1是24号元素,铬元素,G的核电荷数比F多5,所以G是铜元素,故A是H、B是C、C是N、D是O、E是Mg、F是Cr、G是Cu,据依据分析可知:A是H、B是C、C是N、D是O、E是Mg、F是Cr、G是Cu,
(1)G是Cu,Cu在周期表中的位置第四周期第ⅠB族,F是Cr,Cr元素的原子基态价层电子排布式为:3d54s1,故答案为:第四周期第IB族;3d54s1;
(2)BD2是CO2,二氧化碳C分别与2个O成两对共价键,故电子式为: ,CA3为NH3,氨气的空间立体构型为:三角锥形,
,CA3为NH3,氨气的空间立体构型为:三角锥形,
故答案为: ;三角锥形;
;三角锥形;
(3)H元素分别与C、O元素形成的两种微粒H、I都具有N2H4相似的结构,属于等电子数微粒,N2H4中电子数是:18,故与其属于等电子体的是乙烷和双氧水,它们的化学式分别是:C2H6,H2O2,故答案为:C2H6;H2O2;
(4)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,再向该溶液中加入一定量乙醇,难溶物溶解得到深蓝色的透明溶液:[Cu(NH3)4]SO4,故[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键;
故答案为:共价键、离子键、配位键;
(5)依据(3)可知H为:C2H6,在25℃、101kPa下,0.3g乙烷的物质的量为:
=0.01mol,0.01mol燃烧生成CO2和液态水时放热QkJ,则30g(1mol)乙烷完全燃烧生成二氧化碳和液态水放出的热量为100×QKJ=100QKJ,则乙烷燃烧热的热化学方程式为:C2H6(g)+
O2(g)=2CO2(g)+3H2O(l)△H=-100QkJ/mol,乙烷燃料电池中,乙烷作负极,C燃烧产物为二氧化碳,二氧化碳与氢氧根反应生成碳酸根,故负极电极反应方程式为:C2H6-14e-+18OH-=2CO32-+12H2O,故答案为:C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)△H=-100QKJ/mol;C2H6-14e-+18OH-=2CO32-+12H2O;
(6)该晶胞中Cu的个数为:8×
+1=2,O为1,故Cu与O的个数比为2:1,故该氧化物分子式为:Cu2O,故答案为:Cu2O.
(1)G是Cu,Cu在周期表中的位置第四周期第ⅠB族,F是Cr,Cr元素的原子基态价层电子排布式为:3d54s1,故答案为:第四周期第IB族;3d54s1;
(2)BD2是CO2,二氧化碳C分别与2个O成两对共价键,故电子式为:
 ,CA3为NH3,氨气的空间立体构型为:三角锥形,
,CA3为NH3,氨气的空间立体构型为:三角锥形,故答案为:
 ;三角锥形;
;三角锥形;(3)H元素分别与C、O元素形成的两种微粒H、I都具有N2H4相似的结构,属于等电子数微粒,N2H4中电子数是:18,故与其属于等电子体的是乙烷和双氧水,它们的化学式分别是:C2H6,H2O2,故答案为:C2H6;H2O2;
(4)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,再向该溶液中加入一定量乙醇,难溶物溶解得到深蓝色的透明溶液:[Cu(NH3)4]SO4,故[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键;
故答案为:共价键、离子键、配位键;
(5)依据(3)可知H为:C2H6,在25℃、101kPa下,0.3g乙烷的物质的量为:
| 0.3g |
| 30g/mol |
| 7 |
| 2 |
(6)该晶胞中Cu的个数为:8×
| 1 |
| 8 |
点评:本题以元素的推断为载体,主要考查了元素位置的判断、电子式书写、分子空间构型、热化学反应方程式、晶胞的计算等,综合性较强,有一定难度.

练习册系列答案
相关题目
下列实验操作,现象或装置正确的是( )
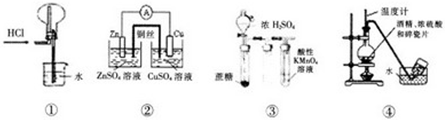

| A、实验①,氯化氢气体的吸收 |
| B、实验②,铜锌原电池 |
| C、实验③:酸性KMnO4溶液中出现气泡,且颜色不变 |
| D、实验④:实验室制取收集乙烯 |
压强对下列反应体系的反应速率影响不大的是( )
| A、N2+3H2?2NH3 |
| B、H2 (g)+I2 (g)?2HI(g) |
| C、2NO2?N2O4 |
| D、HCl+NaOH?NaCl+H2O |
下列说法正确的是( )
| A、铁在空气中燃烧可生成氧化铁,镁在空气中燃烧可生成氧化镁、氮化镁 |
| B、分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 |
| C、红宝石、蓝宝石的主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐 |
| D、针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |


 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol. 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.