题目内容
10.下列酸溶液的pH相同时,其物质的量浓度最小的是( )| A. | H2S | B. | H2SO4 | C. | HClO | D. | HNO3 |
分析 pH相等的强酸溶液,元数越大其浓度越小;元数相同的酸溶液,酸性越弱,pH相同时其浓度越大,据此分析解答.
解答 解:pH相等的强酸溶液,元数越大其浓度越小;元数相同的酸溶液,酸性越弱,pH相同时其浓度越大,硫酸是二元强酸、氢硫酸是二元弱酸,pH相等时硫酸浓度小于氢硫酸;次氯酸是一元弱酸、硝酸是一元强酸,pH相等的次氯酸和硝酸,次氯酸浓度大于硝酸;
硝酸和硫酸都是强酸,pH相等时硫酸浓度小于硝酸,所以pH相等时,物质的量浓度最小的是硫酸,
故选B.
点评 本题考查了电解质的电离及物质浓度与溶液pH的关系,明确决定溶液pH大小的因素是解本题关键,采用对比的方法分析解答,题目难度中等.

练习册系列答案
相关题目
20.根据图,下列判断正确的是( )


| A. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| B. | 烧杯b中发生的电极反应为Zn-2e-═Zn2+ | |
| C. | 烧杯a中发生反应O2+4H++4e-═2H2O,溶液pH降低 | |
| D. | 向烧杯a中加入少量KSCN溶液,则溶液会变成红色 |
1.在给定的条件下,下列物质间的转化均能实现的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH溶液}{→}$NaNO3 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3$\stackrel{NaOH溶液}{→}$NaSiO3 | |
| D. | NaSO4溶液$\stackrel{BaCl_{2}溶液}{→}$BaSO4$\stackrel{盐酸}{→}$BaCl2 |
18.将2g氢氧化钠固体分别加入下列100mL溶液中,导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5mol/L的盐酸 | ||
| C. | 0.5mol/L的醋酸 | D. | 0.5mol/L的氯化钾溶液 |
5.一定条件下,钠能跟二氧化碳发生如下反应:4Na+3CO2=2Na2CO3+C.由此反应不能说明的是( )
| A. | 钠显示了强还原性 | B. | 二氧化碳是酸性氧化物 | ||
| C. | 金属钠熔点较低 | D. | 二氧化碳也能起助燃作用 |
15.某小组为研究电化学原理,设计了如图所示的电化学装置,电极Ⅰ为锌,其他电极均为石墨盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液,下列叙述正确的是( )
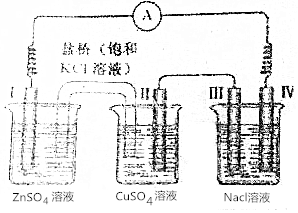

| A. | 电子由电极Ⅳ通过外电路流向电极Ⅰ | |
| B. | 装置工作过程中Ⅲ电极周围出现红色 | |
| C. | 电极Ⅱ发生还原反应 | |
| D. | 盐桥中Cl-向乙池移动 |
2.T℃时,N2与H2反应生成NH3,其能量变化如图(Ⅰ)所示.若保持其他条件不变,温度分别为T1℃和T2℃时,H2的体积分数与时间的关系如图(Ⅱ)所示.则下列结论不正确的是( )
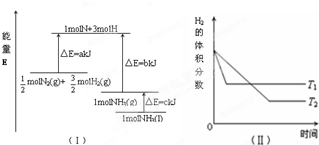

| A. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | 该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1 | |
| C. | T1>T2,且正反应为放热反应 | |
| D. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 |
19.化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境保护问题.下列操作不是围绕上述问题的是( )
| A. | 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停业加热 | |
| B. | 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气 | |
| C. | 实验室制备CO气体必须在通风橱中进行 | |
| D. | 蒸馏操作时应在混合液中加入沸石 |
20.下列说法错误的是( )
| A. | NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO) | |
| B. | 常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1 | |
| C. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-) |