题目内容
6.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )| A. | 1molCH3+所含的电子数为9NA | |
| B. | 标准状况下,11.2 L HF的分子数为0.5NA | |
| C. | 39 g Na2O2与足量水反应,转移电子数为NA | |
| D. | 1 mol乙醇中含有共用电子对数为8NA |
分析 A.CH3+中含8个电子;
B.标况下,HF为液体;
C.Na2O2与足量水反应,过氧化钠既是氧化剂又是还原剂,所以1mol Na2O2与足量水反应转移的电子的物质的量为1mol;
D.1个C2H6O中含8对共用电子对来计算.
解答 解:A.1molCH3+所含的电子数为8NA,故A错误;
B.标况下,HF为液体,不能使用气体摩尔体积,故B错误;
C.39 g Na2O2物质的量为$\frac{39g}{78g/mol}$=0.5mol,与足量水反应,转移电子数为0.5NA,故C错误;
D.1个C2H6O中含8对共用电子对,所以1 mol乙醇中含有共用电子对数为8NA,故D正确;
故选:D.
点评 本题考查阿伏伽德罗常数的使用及有关计算,难度不大,注意气体摩尔体积的使用范围和条件,注意乙醇分子的构成是解题关键,题目难度不大.

练习册系列答案
相关题目
17.卢瑟福是最伟大的实验科学家之一.他对原子结构模型研究的突出贡献在于( )
| A. | 发现了电子 | B. | 根据α提出了带核的原子结构模型 | ||
| C. | 引入的量子学说 | D. | 提出较为系统的化学原子学说 |
14.二氧化碳的回收利用是环保领域研究热点.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是缩小容器体积.该温度下0~10min内H2的反应速率为0.06mol•L-1•min-1.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
1.在给定的条件下,下列物质间的转化均能实现的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH溶液}{→}$NaNO3 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3$\stackrel{NaOH溶液}{→}$NaSiO3 | |
| D. | NaSO4溶液$\stackrel{BaCl_{2}溶液}{→}$BaSO4$\stackrel{盐酸}{→}$BaCl2 |
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 2L 1mol/L过氧化氢溶液中含氧原子数为4NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 2mol MnO2与足量的浓盐酸加热充分反应,转移电子数为4NA | |
| D. | 密闭容器中2molNO2和1molO2充分反应,产物分子数为2NA |
18.将2g氢氧化钠固体分别加入下列100mL溶液中,导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5mol/L的盐酸 | ||
| C. | 0.5mol/L的醋酸 | D. | 0.5mol/L的氯化钾溶液 |
15.某小组为研究电化学原理,设计了如图所示的电化学装置,电极Ⅰ为锌,其他电极均为石墨盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液,下列叙述正确的是( )
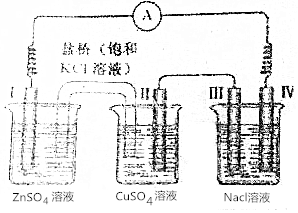

| A. | 电子由电极Ⅳ通过外电路流向电极Ⅰ | |
| B. | 装置工作过程中Ⅲ电极周围出现红色 | |
| C. | 电极Ⅱ发生还原反应 | |
| D. | 盐桥中Cl-向乙池移动 |