题目内容
9.下列关于胶体的说法正确的是( )| A. | 直径介于1-100纳米之间的微粒称为胶体 | |
| B. | 当光束通过胶体时,看到的“光柱”是由于光被胶体粒子散射而形成的 | |
| C. | 胶体的分散质不能透过滤纸的孔隙 | |
| D. | 溶液时电中性的,胶体是带电的 |
分析 A.胶体是指分散质粒子直径在1 nm~100 nm之间的分散系;
B.胶体具有丁达尔效应属于光的散射现象;
C.胶体能透过滤纸;
D.溶液是呈电中性的分散系,胶体微粒有的吸附离子带电.
解答 解:A.微粒不是分散系,不是胶体,故A错误;
B.胶体具有丁达尔效应属于光的散射现象,当光束通过胶体时,看到的“光柱”是由于光被胶体粒子散射而形成的,故B正确;
C.胶粒能透过滤纸,故C错误;
D.溶液中正电荷总数等于负电荷总数,所以溶液是电中性,胶体微粒有的吸附带电,有的不吸附电荷,故D错误.
故选B.
点评 本题考查胶体的性质,题目难度不大,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
19.下列电离方程式书写正确的是( )
| A. | H2S?2H++S2- | B. | H2S+H2O?H3O++HS- | ||
| C. | HCl?H++Cl- | D. | HClO═H++ClO- |
20.根据图,下列判断正确的是( )


| A. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| B. | 烧杯b中发生的电极反应为Zn-2e-═Zn2+ | |
| C. | 烧杯a中发生反应O2+4H++4e-═2H2O,溶液pH降低 | |
| D. | 向烧杯a中加入少量KSCN溶液,则溶液会变成红色 |
17.卢瑟福是最伟大的实验科学家之一.他对原子结构模型研究的突出贡献在于( )
| A. | 发现了电子 | B. | 根据α提出了带核的原子结构模型 | ||
| C. | 引入的量子学说 | D. | 提出较为系统的化学原子学说 |
4.下列有关物质用途的说法中,不正确的是( )
| A. | NH3常用作制冷剂 | B. | 烧碱:治疗胃酸过多的一种药剂 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
14.二氧化碳的回收利用是环保领域研究热点.
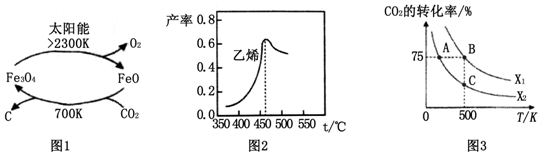
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是缩小容器体积.该温度下0~10min内H2的反应速率为0.06mol•L-1•min-1.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
1.在给定的条件下,下列物质间的转化均能实现的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH溶液}{→}$NaNO3 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3$\stackrel{NaOH溶液}{→}$NaSiO3 | |
| D. | NaSO4溶液$\stackrel{BaCl_{2}溶液}{→}$BaSO4$\stackrel{盐酸}{→}$BaCl2 |
18.将2g氢氧化钠固体分别加入下列100mL溶液中,导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5mol/L的盐酸 | ||
| C. | 0.5mol/L的醋酸 | D. | 0.5mol/L的氯化钾溶液 |
19.化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境保护问题.下列操作不是围绕上述问题的是( )
| A. | 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停业加热 | |
| B. | 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气 | |
| C. | 实验室制备CO气体必须在通风橱中进行 | |
| D. | 蒸馏操作时应在混合液中加入沸石 |