题目内容
某实验小组同学进行如图1实验,以探究化学反应中的能量变化.
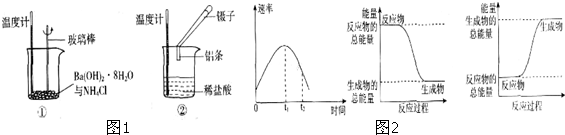
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是 (填“吸热”或“放热”)反应.
(2)实验②中,该小组同学在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图2A所示,该反应是 (填“吸热”或“放热”)反应,其能量变化可用图2中的 (填“B”或“C”)表示.图A中0一tl段化学反应速率变化的原因是 .

(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是
(2)实验②中,该小组同学在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图2A所示,该反应是
考点:中和热的测定
专题:实验题
分析:(1)温度升高,则反应放热;温度降低则反应吸热;
(2)浓度越小,反应速率越小,温度越高,速率越大;放热反应中,反应物的总能量大于生成物的总能量,吸热反应中,反应物的总能量小于生成物的总能量;根据金属与酸的反应为放热反应分析.
(2)浓度越小,反应速率越小,温度越高,速率越大;放热反应中,反应物的总能量大于生成物的总能量,吸热反应中,反应物的总能量小于生成物的总能量;根据金属与酸的反应为放热反应分析.
解答:
解:(1)①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是吸热反应,故答案为:吸热;
(2)在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量;金属与酸的反应为放热反应,温度影响反应的速率,温度越高,反应的速率越快;
故答案为:放热;B;温度升高,反应的速率加快.
(2)在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量;金属与酸的反应为放热反应,温度影响反应的速率,温度越高,反应的速率越快;
故答案为:放热;B;温度升高,反应的速率加快.
点评:此题是一道实验探究题,解题的关键是分析实验的过程,并结合题中所给的信息结合所学相关知识对问题进行探讨与分析.

练习册系列答案
相关题目
下列装置所示的实验中,能达到实验目的是( )
A、 排水法收集NO |
B、 实验室制取并收集氧气 |
C、 除去氯气中的HCl |
D、 分离碘酒中的碘与酒精 |
 如图为以惰性电极进行电解:
如图为以惰性电极进行电解: