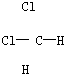题目内容
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图1所示(气密性已检验,部分夹持装置略):
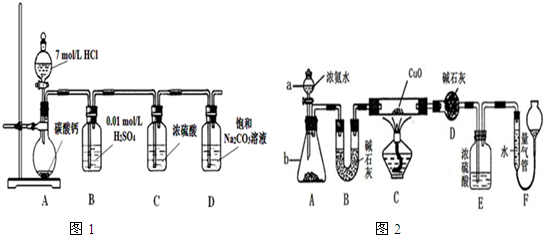
(1)请结合化学平衡移动原理解释B中溶液的作用 .
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是 .
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图2实验(夹持装置未画出)进行实验.请回答下列问题:
(1)仪器b中可选择的试剂为(任意填一种) .
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体.实验前称取黑色CuO 80g,实验后得到红色固体质量为68g.则红色固体成分的化学式为 .
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积 (填“偏大”或“偏小”或“无影响”).
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据 (填序号).
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是 .

(1)请结合化学平衡移动原理解释B中溶液的作用
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图2实验(夹持装置未画出)进行实验.请回答下列问题:
(1)仪器b中可选择的试剂为(任意填一种)
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体.实验前称取黑色CuO 80g,实验后得到红色固体质量为68g.则红色固体成分的化学式为
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是
考点:氨的制取和性质,探究碳酸钠与碳酸氢钠的性质
专题:实验题
分析:Ⅰ.(1)B中酸可抑制二氧化碳的溶解,且能够吸收二氧化碳中的氯化氢气体;
(2)样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,据此写出反应的离子方程式;
Ⅱ.(1)浓氨水滴入锥形瓶中利用固体溶解放热使一水合氨分解生成氨气,需要选择氢氧化钠固体,氧化钙固体或碱石灰;
(2)C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,依据数据分析计算判断;
(3)依据量气管的使用原理回答,F中左边液面低于右边液面,会导致读取的气体体积偏小;
(4)想测得氨气分子中氮、氢原子个数比,须读取F装置实验前后液面差VL,D装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是防止F中水蒸气进入D中,并吸收氨气,防止影响水的质量测定.
(2)样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,据此写出反应的离子方程式;
Ⅱ.(1)浓氨水滴入锥形瓶中利用固体溶解放热使一水合氨分解生成氨气,需要选择氢氧化钠固体,氧化钙固体或碱石灰;
(2)C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,依据数据分析计算判断;
(3)依据量气管的使用原理回答,F中左边液面低于右边液面,会导致读取的气体体积偏小;
(4)想测得氨气分子中氮、氢原子个数比,须读取F装置实验前后液面差VL,D装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是防止F中水蒸气进入D中,并吸收氨气,防止影响水的质量测定.
解答:
解:Ⅰ.(1)B中酸可抑制二氧化碳的溶解,则B中溶液的作用为:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体,
故答案为:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;
(2)样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,反应的离子反应为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O,
故答案为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;
Ⅱ.(1)仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,所以仪器b中可选择的试剂为氢氧化钠固体、氧化钙固体、碱石灰固体,
故答案为:碱石灰或生石灰或氢氧化钠固体;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,实验前称取黑色CuO 80g,物质的量为1mol,依据铜元素守恒,结合红色物质可能为铜或氧化亚铜,若为铜质量为64g,若为氧化亚铜质量=0.5mol×144g/mol=72g,实验后得到红色固体质量为68g.则红色固体成分的化学式为Cu和Cu2O;
故答案为:Cu和Cu2O;
(3)量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,
故答案为:偏小;
(4)若测得干燥管D增重为水物质的量,装置F测得气体的体积为为N2,计算得到气体物质的量,依据元素守恒得到氮原子和氢原子物质的量之比,所以选择b、c,
故答案为:b、c;
(5)干燥管D增重为水物质的量,E装置中浓硫酸的作用是防止F中水蒸气进入D中,并吸收氨气,
故答案为:防止F中水蒸气进入D中,并吸收氨气.
故答案为:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;
(2)样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,反应的离子反应为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O,
故答案为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;
Ⅱ.(1)仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,所以仪器b中可选择的试剂为氢氧化钠固体、氧化钙固体、碱石灰固体,
故答案为:碱石灰或生石灰或氢氧化钠固体;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,实验前称取黑色CuO 80g,物质的量为1mol,依据铜元素守恒,结合红色物质可能为铜或氧化亚铜,若为铜质量为64g,若为氧化亚铜质量=0.5mol×144g/mol=72g,实验后得到红色固体质量为68g.则红色固体成分的化学式为Cu和Cu2O;
故答案为:Cu和Cu2O;
(3)量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,
故答案为:偏小;
(4)若测得干燥管D增重为水物质的量,装置F测得气体的体积为为N2,计算得到气体物质的量,依据元素守恒得到氮原子和氢原子物质的量之比,所以选择b、c,
故答案为:b、c;
(5)干燥管D增重为水物质的量,E装置中浓硫酸的作用是防止F中水蒸气进入D中,并吸收氨气,
故答案为:防止F中水蒸气进入D中,并吸收氨气.
点评:本题考查了化学平衡移动原理应用、离子方程式的书写、氨气的实验室制备,题目难度中等,注意掌握化学平衡移动原理的概念及应用方法,明确离子方程式的书写原则,注意性质验证和反应现象分析判断技巧,装置流程分析,量气装置的使用方法,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列变化属于物理变化的是( )
| A、氧气在放电条件下变成臭氧 |
| B、用干冰降雨 |
| C、漂白的草帽久置于空气中变黄 |
| D、加热胆矾成无水硫酸铜 |

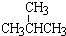 和
和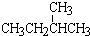 ; ②
; ② 和
和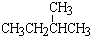 ;
;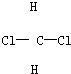 和
和