题目内容
(1)质量比为1:1的SO2气体和SO3气体,其分子数之比为 ,氧原子数之比为 ,相同条件下(同温同压)的体积之比为 ,密度之比为 .
(2)常温下A和B两种气体组成的混合气(A的式量大于B的式量),经分析混合气体只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于
.由此可确定A为 ,B为 ,其理由是 .
(2)常温下A和B两种气体组成的混合气(A的式量大于B的式量),经分析混合气体只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于
| 14 |
| 3 |
考点:物质的量的相关计算
专题:推断题
分析:(1)根据n=
=
=
结合ρ=
以及分子的构成解答该题;
(2)NH3中氮元素和氢元素的质量比是14:(1×3)=14:3,据此进行分析判断.
| m |
| M |
| N |
| NA |
| V |
| Vm |
| M |
| Vm |
(2)NH3中氮元素和氢元素的质量比是14:(1×3)=14:3,据此进行分析判断.
解答:
解:(1)设SO2与SO3均为1g,则
n(SO2)=
=
mol,
n(SO3)=
=
mol,
则SO2中n(O)=2n(SO2)=
mol,SO3中n(0)=
mol,故分子数之比为
:
=5:4,氧原子数之比为
:
=5:6.
据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2):V(SO3)=5:4,
密度之比等于摩尔质量之比,即ρ(SO2):ρ(SO3)=64:80=4:5.
故答案为:5:4;5:6;5:4;4:5;
(2)根据题意,常温下,A、B两种气体组成的混合物(A的相对分子质量大于B),经分析混合气体中只含氮、氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于
,NH3中氮元素和氢元素的质量比是14:(1×3)=14:3,与N2混合,氮和氢的质量比总大于
;氨气的相对分子质量为17,氮气的相对分子质量为28,A的相对分子质量大于B,A为N2,B为NH3,
故答案为:N2;NH3;NH3中氮元素和氢元素的质量比是14:(1×3)=14:3,与N2混合,氮和氢的质量比总大于
,氨气的相对分子质量为17,氮气的相对分子质量为28,A的相对分子质量大于B,A为N2,B为NH3.
n(SO2)=
| 1g |
| 64g/mol |
| 1 |
| 64 |
n(SO3)=
| 1g |
| 80g/mol |
| 1 |
| 80 |
则SO2中n(O)=2n(SO2)=
| 1 |
| 32 |
| 3 |
| 80 |
| 1 |
| 64 |
| 1 |
| 80 |
| 1 |
| 32 |
| 3 |
| 80 |
据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2):V(SO3)=5:4,
密度之比等于摩尔质量之比,即ρ(SO2):ρ(SO3)=64:80=4:5.
故答案为:5:4;5:6;5:4;4:5;
(2)根据题意,常温下,A、B两种气体组成的混合物(A的相对分子质量大于B),经分析混合气体中只含氮、氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于
| 14 |
| 3 |
| 14 |
| 3 |
故答案为:N2;NH3;NH3中氮元素和氢元素的质量比是14:(1×3)=14:3,与N2混合,氮和氢的质量比总大于
| 14 |
| 3 |
点评:本题考查物质的量的计算,侧重于学生的分析能力和计算能力的考查,难度不大,培养学生灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
用FeS跟酸反应制取H2S气体,最好使用的酸是( )
| A、浓盐酸 | B、稀硫酸 |
| C、浓硫酸 | D、稀硝酸 |
下列关于氧化还原反应的说法不正确的是( )
| A、反应SiO2+3C═SiC+2CO中,氧化剂与还原剂的物质的量之比为1:2 |
| B、向蔗糖中加入浓硫酸,蔗糖变黑,并有刺激性气味,说明浓硫酸具有脱水性和强氧化性 |
| C、浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳 |
| D、铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2:3 |
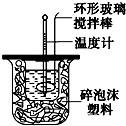 如图装置测定中和热的实验步骤如下:
如图装置测定中和热的实验步骤如下: 图中每一方格表示有关的一种反应物或生成物.已知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其他不含B元素的反应物以及各步反应添加的必要试剂和反应条件均被略去).
图中每一方格表示有关的一种反应物或生成物.已知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其他不含B元素的反应物以及各步反应添加的必要试剂和反应条件均被略去).