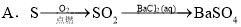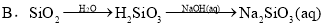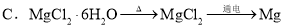题目内容
5.氢气和氧气的混合物气体遇火星即发生爆炸生成水;水在1000oC以上持续加热分解为氢气和氧气;水电解生成氢气和氧气.(1)H2和O2化合生成H2O的反应是放热(填“放热”或“吸热”)反应,H2和O2的总能量大于(填“大于”或“小于”)水的总能量.
(2)水在高温下分解的反应为吸热(填“放热”或“吸热”)反应,反应中热能转化为化学能能.电解水的过程是电能转化为化学能的过程.
(3)下列反应中,△H>0的反应有②③.(填序号)
①铝片与稀盐酸反应 ②Ba (OH)2•8H2O与NH4Cl的反应③碳酸钙高温分解的反应 ④甲烷在空气中燃烧反应
(4)发射火箭时用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水.已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1.
分析 (1)氢气在氧气中燃烧放热,放热反应中反应物能量高于生成物;
(2)水分解是氢气燃烧生成水的逆反应,是吸热反应,热能转化为化学能;电解水是电能转化为化学能;
(3)吸热反应,△H>0;放热反应,△H<0;以及常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),高温下碳或H2还原金属氧化物以及某些复分解(如铵盐和强碱);
(4)根据n=$\frac{m}{M}$计算32gN2H4的物质的量,再根据热化学方程式书写原则书写热化学方程式.
解答 解:(1)氢气和氧气的混合物气体遇火星即发生爆炸,可见氢气在氧气中燃烧放热,放热反应中反应物能量高于生成物,
故答案为:放热;大于;
(2)水在1000°C以上持续加热分解为氢气和氧气,水分解是氢气燃烧生成水的逆反应,是吸热反应,热能转化为化学能;电解水是电能转化为化学能,
故答案为:吸热;化学能;电能;化学能;
(3)①铝片与稀盐酸反应是常见放热反应,△H<0,故①错误;
②Ba(OH)2•8H2O与NH4Cl是常见吸热反应,△H>0,故②正确;
③碳酸钙高温分解是常见吸热反应,△H>0,故③正确;
④甲烷在空气中燃烧是常见放热反应,△H<0,故④错误;
故答案为:②③;
(4)32gN2H4的物质的量为$\frac{32g}{32g/mol}$=1mol,与二氧化氮反应生成氮气与气态水放出568kJ的热量,热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1.
点评 本题综合考查化学反应与能量变化,为高频考点,侧重学生对双基的掌握以及相关概念的理解,注意把握放热反应、热化学方程式的书写、反应热的有关计算等,难度不大,注意理解盖斯定律.

| A. | SiO2是由极性键构成的非极性分子 | |
| B. | 若NA表示阿伏伽德罗常数,常温常压下60g SiO2中含有的共价键数目为2NA | |
| C. | 碳和硅同主族,因此CO2和SiO2化学性质相似,物理性质也相似 | |
| D. | SiO2晶体结构中的最小环为6个Si和6个O组成的12元环 |
| A. | 10mL0.1mol/L的AlCl3溶液 | B. | 20mL0.2mol/L的CaCl2溶液 | ||
| C. | 30mL0.2mol/L的KCl溶液 | D. | 10mL0.25mol/L的NaCl溶液 |


 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( )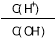 D.
D.
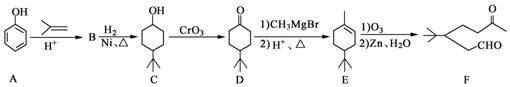
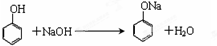 .
. ,A到B的反应类型为加成反应.
,A到B的反应类型为加成反应. (任写一种).
(任写一种).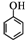 )和CH2=CH2为原料制备有机物 的
)和CH2=CH2为原料制备有机物 的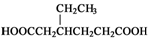 合成路线流程图(无机试剂任用).
合成路线流程图(无机试剂任用).