题目内容
16.下列叙述正确的是( )| A. | 同周期元素的原子半径以ⅦA族的最大 | |
| B. | 同主族两种元素原子的核外电子数的差值可能为36 | |
| C. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素的原子 | |
| D. | 科学家在周期表中金属与非金属分界线处找到了优良的催化剂 |
分析 A.同周期元素中原子半径从左向右逐渐减小;
B.根据核外电子排布判断;同主族相间两种元素的核外电子数相差可能为36;
C.短周期元素中次外层电子数是最外层电子数2倍的元素的有Li、Si等元素;
D.在周期表中金属与非金属分界线常作半导体.
解答 解:A.因同周期元素中原子半径从左向右逐渐减小,则同周期元素中ⅦA族元素的原子半径最小,故A错误;
B.原子的原子序数等于核外电子数,每周期中含有的元素种类数分别为:2、8、8、18、18、32种元素,因此同主族相间的两种元素之间原子序数相差36存在,故B正确;
C.短周期元素中次外层电子数是最外层电子数2倍的元素的有Li、Si两种元素,Li金属,故C错误;
D.在金属和非金属的分界线处元素的单质的导电性介于导体与绝缘体之间,属于半导体,所以在周期表中金属与非金属分界线处找到的是半导体,故D错误.
故选B.
点评 本题考查了同周期元素原子半径大小、同主族元素原子序数关系、最外层核外电子数和此外层电子数的关系,判断元素的种类、以及元素周期律的应用等知识点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.在下列有机物分子中,所有原子不可能处于同一平面的是( )
| A. | CH2=CH-CN | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
4.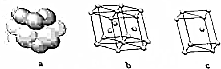 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:
回答下列问题:
(1)写出E、F的元素符号Mg、Cr,B、C、D元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示),A元素分别与B、D元素形成的两种微粒都具有与NH3相似的结构,属于等电子体,它们的化学式依次是CH3-、H3O+.
(2)在CH3Cl、C6H6、HCHO、CH3OH、CH≡CH中,碳原子采取sp2杂化的有C6H6、HCHO;应用价层电子对互斥理论,预测COCl2的空间构型为平面三角形.
(3)F元素的原子基态价层电子排布图是 .
.
(4)E单质晶体中原子的堆积模型如图,晶胞是图中的c(填“a”、“b”或“c”);配位数是12‘若紧邻的四个E原子的中心连线构成的几何体的体积是Vcm3,E单质的密度为ρg•cm-3,则E的相对原子质量是计算式是6NA•V•ρ.
 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:| A | A是原子半径最小的元素 |
| B | B基态原子的价层电子排布式为nsnnpn |
| D | D原子最外层电子数是次外层电子数的三倍 |
| E | C的三价阴离子和E的二价阳离子具有相同的电子层结构 |
| F | F元素的基态原子有六个成单电子 |
(1)写出E、F的元素符号Mg、Cr,B、C、D元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示),A元素分别与B、D元素形成的两种微粒都具有与NH3相似的结构,属于等电子体,它们的化学式依次是CH3-、H3O+.
(2)在CH3Cl、C6H6、HCHO、CH3OH、CH≡CH中,碳原子采取sp2杂化的有C6H6、HCHO;应用价层电子对互斥理论,预测COCl2的空间构型为平面三角形.
(3)F元素的原子基态价层电子排布图是
 .
.(4)E单质晶体中原子的堆积模型如图,晶胞是图中的c(填“a”、“b”或“c”);配位数是12‘若紧邻的四个E原子的中心连线构成的几何体的体积是Vcm3,E单质的密度为ρg•cm-3,则E的相对原子质量是计算式是6NA•V•ρ.
1.下列说法正确的是( )
| A. | 漂白粉漂白物质时发生的发应和变质失效时的反应一样 | |
| B. | 将氯气溶于水中,当水中各成分浓度保持不变时,即表示反应停止 | |
| C. | 二氧化硅固体是由原子直接构成的,那么固态二氧化碳也是由原子直接构成 | |
| D. | 碱金属(如钾、钠等)可以存放在所有有机溶剂中,而白磷则应保存在水中 |
5.实验室需用240mL 1mol/L的氢氧化钠溶液.填空并请回答下列问题:
(1)配制所需体积的 1mol/L的氢氧化钠溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)B、C、A、F、E、D;
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称取所需的氢氧化钠固体,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶,溶液注入容量瓶前需恢复到室温,这是因为容量瓶盛放热溶液时,体积不准,也易导至容量瓶炸裂;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作偏低;若加蒸馏水时不慎超过了刻度偏低;若定容时俯视刻度线偏高.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度宣告实验失败,洗净容量瓶后重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面宣告实验失败,洗净容量瓶后重新配制.
(1)配制所需体积的 1mol/L的氢氧化钠溶液
| 应称取氢氧化钠固体的质量/g | 应选用容量瓶的规格/mL | 除烧杯、托盘天平、容量瓶、量筒外还需的其它仪器 |
| 10.0 | 250 | 玻璃棒、胶头滴管、药匙 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称取所需的氢氧化钠固体,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶,溶液注入容量瓶前需恢复到室温,这是因为容量瓶盛放热溶液时,体积不准,也易导至容量瓶炸裂;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作偏低;若加蒸馏水时不慎超过了刻度偏低;若定容时俯视刻度线偏高.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度宣告实验失败,洗净容量瓶后重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面宣告实验失败,洗净容量瓶后重新配制.
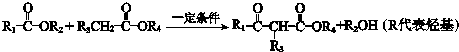
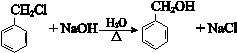 .
. .
. 如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:
如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题: