题目内容
6.(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液的c(OH-)为2×10-7mol/L;KW4×10-14(2)写出氢硫酸在水中电离的方程式:H2S?H++HS-,HS-?H++S2-,
(3)写出NaClO溶液水解的离子方程式ClO-+H2O?HClO+OH-
(4)实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:HCO3-水解使溶液显碱性,HCO3-+H2O?H2CO3+OH-,HCO3-电离使溶液显酸性,HCO3-?H++CO32-,HCO3-的水解程度大于电离程度,所以溶液显碱性.(以离子方程式和简要文字说明):
分析 (1)依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同,Kw=c(H+)c(OH-);
(2)氢硫酸是多元弱酸,水溶液中分步电离,存在电离平衡;
(3)次氯酸根离子水解生成次氯酸和氢氧根离子;
(4)NaHCO3溶液显碱性,说明HCO3-的水解程度大于电离程度.
解答 解:(1)某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=2×10-7mol/L;若温度不变,溶液中Kw=C(H+)C(OH-)=4×10-14,
故答案为:2×10-7;4×10-14;
(2)氢硫酸为二元弱酸,电离分步进行,电离方程式为H2S?H++HS-、HS-?H++S2-,
故答案为:H2S?H++HS-;HS-?H++S2-;
(3)次氯酸根离子水解生成次氯酸和氢氧根离子,离子方程式为ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
(4)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为:HCO3-+H2O?H2CO3+OH-,电离平衡为:HCO3-?H++CO32-;水的电离平衡,H2O?H++OH-;溶液显碱性是因为溶液中碳酸氢根离子的水解程度大于电离程度,
故答案为:HCO3-水解使溶液显碱性,HCO3-+H2O?H2CO3+OH-,HCO3-电离使溶液显酸性,HCO3-?H++CO32-,HCO3-的水解程度大于电离程度,所以溶液显碱性.
点评 本题考查了盐类水解的应用、溶液中离子积的计算判断,题目较简单.侧重于学生的分析能力的考查,注意把握盐类水解的原理以及影响因素,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列叙述正确的是( )
| A. | 同周期元素的原子半径以ⅦA族的最大 | |
| B. | 同主族两种元素原子的核外电子数的差值可能为36 | |
| C. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素的原子 | |
| D. | 科学家在周期表中金属与非金属分界线处找到了优良的催化剂 |
17.常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合. 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸.
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系C. A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+):
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-3-10-11mol•L-1.
(5)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B═H++HB-HB-?H++B2-
回答下列问题:
在 0.1mol•L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
| 实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
| 编号 | 浓度/(mol•L-1) | 浓度/(mol•L-1) | 液的 pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=11 |
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系C. A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+):
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-3-10-11mol•L-1.
(5)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B═H++HB-HB-?H++B2-
回答下列问题:
在 0.1mol•L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
14.把0.05molNaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
| A. | 0.5mol/L KCl溶液 | B. | 自来水 | ||
| C. | 0.5mol/L盐酸 | D. | 0.5mol/L醋酸溶液 |
18.饱和氯水久置后,溶液中的各种粒子:①Cl2②ClO-③Cl-④HClO ⑤H+减小的是( )
| A. | ①②④ | B. | ①②③ | C. | ①④ | D. | ②④ |
15.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含者丰富的化学原理,下列成语中涉及氧化还
原反应的是( )
原反应的是( )
| A. | 铁杵成针 | B. | 抱薪救火 | C. | 闭门造车 | D. | 刻舟求剑 |

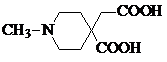 .
.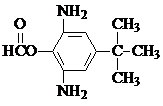 或
或 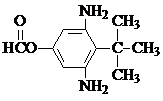 .
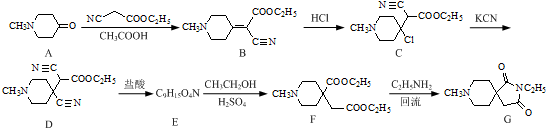
.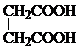 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备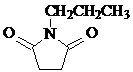 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: