题目内容
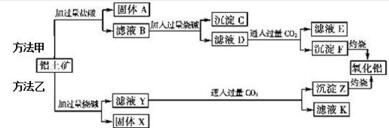
4.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料.以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如图1: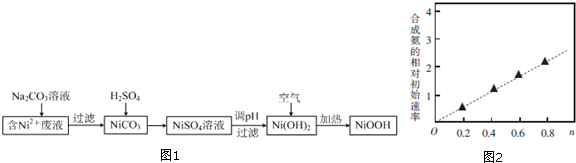
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成,过滤时需用到的玻璃仪器有烧杯、漏斗、琉璃棒.
(2)写出碳酸镍与稀硫酸反应的离子方程式:NiCO3+2H+=Ni2++H2O+CO2↑.
(3)硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n) Fe2 O4.如图表示在其他条件相同时合成氨的相对初始速率随催化 剂中n值变化的曲线,由图2分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
分析 含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH,
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,过滤用到的玻璃仪器有烧杯、漏斗、琉璃棒;
(2)碳酸镍与稀硫酸反应生成硫酸镍、二氧化碳、水,根据电荷守恒和元素守恒可写出反应的离子方程式;
(3)合成氨的相对初始速率随催化剂中n值增大而增大,而n增大,Co2+的比例增大;
(4)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水.
解答 解:含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH,
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成,过滤用到的玻璃仪器有烧杯、漏斗、琉璃棒;
故答案为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;漏斗、琉璃棒;
(2)碳酸镍与稀硫酸反应生成硫酸镍、二氧化碳、水,反应的离子方程式为NiCO3+2H+=Ni2++H2O+CO2↑,
故答案为:NiCO3+2H+=Ni2++H2O+CO2↑;
(3)由图可知,随n值越大,合成氨的相对初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高,
故答案为:Co2+;
(4)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水,原子守恒配平书写化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O,
故答案为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
点评 本题考查了物质分离方法和实验过程分析判断,为高考常见题型,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.

| A. | 28 g C2H4所含共用电子对数目为4NA | |
| B. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 1 mol甲烷分子所含质子数为10NA | |
| D. | 标准状况下,22.4 L乙醇的分子数为NA |
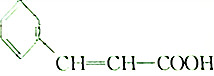
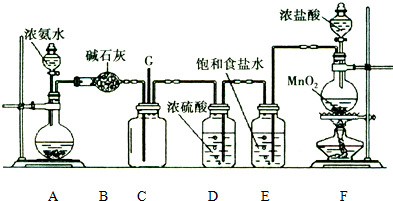
| A. | 该物质能与Na发生反应生成H2 | B. | 该物质能发生加聚反应 | ||
| C. | 该物质在一定件下可发生酯化反应 | D. | 物质的摩尔质量为148 |
| A. | Na+、Ba2+、CO32-、NO3- | B. | Na+、OH-、K+、MnO4- | ||
| C. | K+、HCO3-、SO42-、Na+ | D. | H+、Cl-、Cu2+、SO42- |
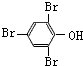 ;化合物H的名称甲酸甲酯.
;化合物H的名称甲酸甲酯.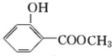 ,
,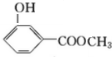 .
.
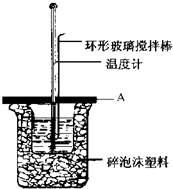 如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).
如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).