题目内容
11.某兴趣小组拟制备氯气并验证其一系列性质.Ⅰ.【查阅资料】
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色.
②硫代硫酸钠溶液在工业上可作为脱氯剂.
Ⅱ.【性质验证】
实验装置如图1所示(省略夹持装置)

实验步骤:
(1)检查装置气密性,按图2加入试剂.仪器a的名称是长颈漏斗;装置CⅡ处加的试剂可以是BD(选填下列字母编号).
A.碱石灰 B.硅胶 C.浓硫酸 D.无水氯化钙
(2)装置B的作用有除去氯气中的氯化氢并作安全瓶.
(3)写出装置F中相应的离子反应方程式:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
Ⅲ.【探究与反思】
(1)图1中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的,其理由是未排除Cl2对溴、碘的非金属性的强弱实验的干扰.该组的同学思考后将上述D、E、F装置改为实验操作步骤如下:
①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹.
③当a中溶液由黄色变为棕色时,停止通氯气.
④打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c震荡.
(2)设计步骤③的实验思想是对比实验思想.
(3)步骤④的操作是打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c震荡.
分析 由图中装置可知,装置A中放入二氧化锰、分液漏斗中放入浓盐酸,加热产生的氯气通入饱和食盐水除去其中的氯化氢气体,然后通入C,Ⅰ、Ⅲ处放干燥的有色布条,Ⅱ放入固体粒状干燥剂,但不能是碱性干燥剂,否则会吸收氯气,可观察到Ⅰ处布条褪色,Ⅲ处不褪色,氯气通入漏斗D中,溶液变橙色,再滴入KI溶液与苯的分层的液体中,苯层呈紫色,最后多余的氯气用硫代硫酸钠溶液吸收,Na2S2O3中硫显+2价,被氯气氧化SO42-;为排除氯气对其溴碘检验的干拢,可进行对比实验,以此来解答.
解答 解:Ⅱ.(1)仪器a的名称是长颈漏斗;装置CⅡ处加的试剂干燥氯气,且为固体,只有BD符合,故答案为:长颈漏斗;BD;
(2)生成的氯气中混有HCl,则装置B的作用有除去氯气中的氯化氢并作安全瓶,故答案为:除去氯气中的氯化氢并作安全瓶;
(3)Na2S2O3中硫显+2价,被氯气氧化SO42-,则装置F中相应的离子反应方程式S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
Ⅲ.(1)装置D、E的目的是比较氯、溴、碘的非金属性,但氯气可与NaBr、KI均反应,未排除Cl2对溴、碘的非金属性的强弱实验的干扰,不能比较Cl、Br、I的非金属性,故答案为:未排除Cl2对溴、碘的非金属性的强弱实验的干扰;
(2)设计步骤③的实验思想是对比实验思想,故答案为:对比实验思想;
(3)改进的实验步骤④为打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c震荡,第④步发生溴与KI的反应,
故答案为:打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c震荡.
点评 本题考查氯气的制备实验及性质实验,为高频考点,把握实验装置的作用、物质的性质及非金属性比较的方法为解答的关键,侧重分析与实验能力的考查,注意实验中对比方法及干扰因素的分析,题目难度中等.

| 溶质 溶解度 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 170 | 9.2 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
①水中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
②液氨中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
③水中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
④液氨中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
判断上述反应能发生的是( )
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
| A. | 次氯酸的电子式: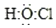 | |
| B. | 中子数为 20 的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氮原子的结构示意图: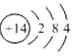 | |
| D. | Na2 S 的水解反应方程式:S2-+2H2O?H2S+2OH- |
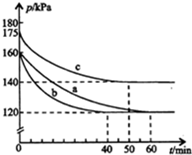 在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )| A. | Q<0 | |
| B. | 与实验a相比,实验b加入了催化剂 | |
| C. | 实验b条件下,该反应的平衡常数K=2 | |
| D. | 实验c从反应开始至达到平衡时的平均反应速率为v(AX5)=4.0×10-3mol/(L•min) |
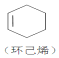
 +
+ →
→
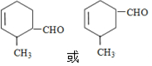 .
.
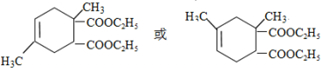 .
. .
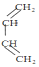
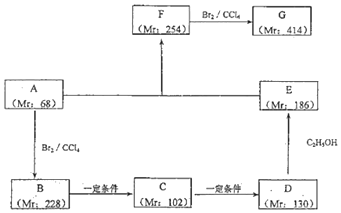
.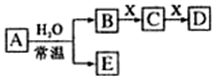 A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题:
A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题: ; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;
; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;