题目内容
下列有关卤族元素的叙述不正确的是( )
| A、卤素单质从F2到I2,颜色加深,熔沸点升高 |
| B、卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 |
| C、卤族元素从F到I,HX水溶液酸性增强 |
| D、卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来 |
考点:卤素原子结构及其性质的比较
专题:
分析:A、卤素单质都是分子晶体,熔沸点的高低与分子间作用力的大小有关,而决定分子间作用力在因素是相对分子量的大小;
B、卤族元素从Cl到I,非金属性在减弱,所以最高价氧化物对应水化物的酸性减弱;
C、卤族元素从F到I,原子半径在增大,所以同浓度的HX水溶液酸性增强;
D、F2与盐溶液反应是与溶剂水反应.
B、卤族元素从Cl到I,非金属性在减弱,所以最高价氧化物对应水化物的酸性减弱;
C、卤族元素从F到I,原子半径在增大,所以同浓度的HX水溶液酸性增强;
D、F2与盐溶液反应是与溶剂水反应.
解答:
解:A、卤素单质都是分子晶体,熔沸点的高低与分子间作用力的大小有关,而决定分子间作用力在因素是相对分子量的大小,所以从F2到I2,颜色加深,熔沸点升高,故A正确;
B、卤族元素从Cl到I,非金属性在减弱,所以最高价氧化物对应水化物的酸性减弱,故B正确;
C、卤族元素从F到I,原子半径在增大,所以同浓度的HX水溶液酸性增强,故C正确;
D、F2与盐溶液反应是与溶剂水反应,不能发生置换反应,故D错误;
故选D.
B、卤族元素从Cl到I,非金属性在减弱,所以最高价氧化物对应水化物的酸性减弱,故B正确;
C、卤族元素从F到I,原子半径在增大,所以同浓度的HX水溶液酸性增强,故C正确;
D、F2与盐溶液反应是与溶剂水反应,不能发生置换反应,故D错误;
故选D.
点评:本题考查了元素周期律,明确同一主族元素周期律的内涵是解本题关键,知道非金属元素非金属性强弱的判断方法,根据元素的非金属性强弱结合元素周期律来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
新鲜水果、蔬菜、果汁中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,用淀粉溶液作指示剂,其化学方程式为:下列说法正确的是( )


| A、上述反应为氧化反应 |
| B、脱氢维生素C的分子式为C6H6O6 |
| C、滴定时应剧烈振荡锥形瓶 |
| D、终点时溶液由蓝色恰好变无色 |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.下列说法不正确的是( )
| A、原子半径:Y>Z>W |
| B、非金属性最强的元素为W |
| C、Y的最高价氧化物的熔点较高 |
| D、XW2分子中各原子最外层电子均达到8电子结构 |
下列物质的用途中,利用了物质的氧化性的是( )
| A、用漂白粉消毒游泳池中的水 |
| B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) |
| C、用食盐腌渍食物 |
| D、用小苏打治疗胃酸过多 |
下列物质中分子内和分子间均可形成氢键的是( )
| A、NH3 |
B、 |
| C、H2S |
| D、C2H5OH |
推测下列最适合溶解白磷(P4)的溶剂是( )
| A、水 |
| B、CH3OH(甲醇) |
| C、CS2 (二硫化碳) |
| D、CH3COOH (乙酸) |
不能判别碳和硅非金属性强弱的事实是( )
| A、在碳化硅(SiC)中硅元素显正价 |
| B、常温下碳酸不稳定,极易分解,硅酸相对稳定 |
| C、在自然界,甲烷比甲硅烷稳定 |
| D、相同条件下,硅酸的酸性低于碳酸 |
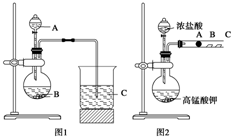 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.(已知高锰酸钾与浓盐酸反应生成氯气)
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.(已知高锰酸钾与浓盐酸反应生成氯气) 某学生在A、B、C、D四只小烧瓶中分别放入:干燥的细铁丝;浸过食盐水的细铁丝;浸过清水的细铁丝.然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如表(表中所列数据为导管中水面上升的高度/cm)
某学生在A、B、C、D四只小烧瓶中分别放入:干燥的细铁丝;浸过食盐水的细铁丝;浸过清水的细铁丝.然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如表(表中所列数据为导管中水面上升的高度/cm)