题目内容
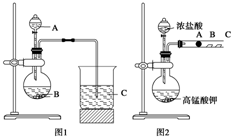 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.(已知高锰酸钾与浓盐酸反应生成氯气)
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.(已知高锰酸钾与浓盐酸反应生成氯气)(1)甲同学设计实验的依据是
(2)乙同学所设计的实验中,圆底烧瓶中发生的反应的化学方程式:
考点:同一主族内元素性质递变规律与原子结构的关系,非金属在元素周期表中的位置及其性质递变的规律
专题:
分析:(1)验证元素非金属性,由图可知应是利用最高价含氧酸的酸性强弱比较,利用强酸制弱酸原理分析,A中为稀硝酸,B为碳酸钙,C中为硅酸钠,硝酸与碳酸钙反应生成二氧化碳、硝酸钙和水,二氧化碳与硅酸钠溶液反应生成硅酸沉淀;
(2)浓盐酸和高锰酸钾在常温下发生氧化还原反应生成氯气,非金属性Cl>Br>I,单质的氧化性Cl2>Br2>I2,卤素单质之间可发生置换反应.
(2)浓盐酸和高锰酸钾在常温下发生氧化还原反应生成氯气,非金属性Cl>Br>I,单质的氧化性Cl2>Br2>I2,卤素单质之间可发生置换反应.
解答:
解:(1)验证元素非金属性,由图可知应是利用最高价含氧酸的酸性强弱比较,A中为稀硝酸,B为碳酸钙,C为硅酸钠,利用强酸制弱酸原理分析,硝酸与碳酸钙反应生成二氧化碳、硝酸钙和水,其反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,二氧化碳与硅酸钠溶液反应生成硅酸沉淀,硅酸沉淀为白色胶状沉淀,则C中发生的反应为SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;
故答案为:强酸制弱酸;CO32-+2H+=CO2↑+H2O;生成白色胶状沉淀;SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;
(2)浓盐酸和高锰酸钾在常温下发生氧化还原反应生成氯气,其反应的方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;单质的氧化性Cl2>Br2>I2,则B处氯气通过湿润的淀粉KI试纸,氯气与KI反应2I-+Cl2═2Cl-+I2,生成碘单质,碘遇淀粉变蓝色.
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;湿润的淀粉碘化钾试纸变为蓝色,2I-+Cl2═2Cl-+I2.
故答案为:强酸制弱酸;CO32-+2H+=CO2↑+H2O;生成白色胶状沉淀;SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;
(2)浓盐酸和高锰酸钾在常温下发生氧化还原反应生成氯气,其反应的方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;单质的氧化性Cl2>Br2>I2,则B处氯气通过湿润的淀粉KI试纸,氯气与KI反应2I-+Cl2═2Cl-+I2,生成碘单质,碘遇淀粉变蓝色.
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;湿润的淀粉碘化钾试纸变为蓝色,2I-+Cl2═2Cl-+I2.
点评:本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法.

练习册系列答案
相关题目
某烃含碳的质量分数为80%,则下列说法中,错误的是( )
| A、该烃的最简式为CH2 |
| B、该烃与甲烷互为同系物 |
| C、该烃的分子式可以是(C2H2)n(n=1,2,3,…) |
| D、该烃的相对分子质量为30 |
下列加点字的含义不是指“元素”的是( )
A、
| ||||
B、
| ||||
C、山泉水中含有
| ||||
D、
|
下列变化过程中,只破坏共价键的是( )
| A、冰变水 |
| B、将Na2SO4熔融呈液态 |
| C、HCl溶于水得盐酸 |
| D、从NH4HCO3中闻到了刺激性气味 |
一氧化碳与氢气在催化剂作用下合成甲醇的反应为:CO(g)+2H2 (g)?CH3OH(g).在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温.实验测得相关数据如图(1、2),温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系;温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数.下列有关说法正确的是( )


| A、K1<K2 |
| B、该反应的正反应是气体体积减小的吸热反应 |
| C、将容器c中的平衡态转变到容器d中的平衡态,可采取的措施有升温或减压 |
| D、反应到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动 |
下列有关卤族元素的叙述不正确的是( )
| A、卤素单质从F2到I2,颜色加深,熔沸点升高 |
| B、卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 |
| C、卤族元素从F到I,HX水溶液酸性增强 |
| D、卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来 |
化学工作者把烷烃、烯烃、环烷烃、炔烃…的通式转化成键数的通式,给研究有机物分子中键能大小的规律带来了很大方便.设键数为I,则烷烃中碳原子数跟键数关系的通式为CnI3n+1,烯烃(视双键为两条单键)、环烷烃中碳原子数跟键数关系的通式为CnI3n,则苯的同系物中碳原子数跟键数关系的通式为( )
| A、CnI3n-1 |
| B、CnI3n-2 |
| C、CnI3n-3 |
| D、CnI3n-4 |