题目内容
17.化学实验是化学学科学习、探究的基础.(1)下列描述错误的是acde.
a.为了防止试剂瓶内的试剂被污染,取用后多余的试剂一定都不能放回原试剂瓶
b.滴定管、容量瓶、分液漏斗在使用时都需要检漏
c.海带中碘的提取时需要对干海带进行灼烧,此时需要用到的仪器有玻璃棒、燃烧匙、泥三角、三脚架、酒精灯
d.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入Ba(NO3)2溶液,产生白色沉淀,滴加稀盐酸,观察白色沉淀是否溶解
e.海带中碘的提取时,对碘水中的碘进行萃取可采用裂化汽油、苯、四氯化碳、无水酒精等有机溶剂
(2)某溶液中可能存在Br-、CO32-、SO32-、I-、A13+、Mg2+、Na+等7种离子中的某几种.现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入稀盐酸沉淀不溶解.
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液肯定存在的离子是:CO32-、SO32-、Br-、Na+
在②中产生的自色沉淀是:BaSO4.
分析 (1)a.不是所有的试剂都不能放回原瓶,如金属钠,取用后必须放回原瓶;
b.滴定管、容量瓶、分液漏斗在使用时需要检查是否漏液,防止液体漏出;
c.灼烧固体时应在坩埚中进行;
d.检验亚硫酸钠是否被氧化,不能选择硝酸钡和盐酸;
e.无水酒精你能不能作碘的萃取剂;
(2)①加入足量氯水后溶液变为橙色,说明有溴单质生成,原溶液中存在Br-;且产生气泡,因为氯水呈酸性,与氯水反应产生气体的离子应是CO32-,而不是亚硫酸根离子,因为氯水与亚硫酸根离子发生氧化还原反应生成硫酸根离子;因为含有碳酸根离子,所以A13+、Mg2+不存在,则阳离子只能是Na+;
②加入氯化钡溶液产生不溶于盐酸的白色沉淀,则①所得的溶液中一定含有硫酸根离子,说明原溶液中存在SO32-,被氯水氧化为硫酸根离子,与钡离子反应生成BaSO4白色沉淀;
③说明溶液中不存在I-,其余离子不能确定.
解答 解:(1)a.不是所有的试剂都不能放回原瓶,如金属钠,取用后必须放回原瓶,故a错误;
b.滴定管、容量瓶、分液漏斗在使用时需要检查是否漏液,防止液体漏出,故b正确;
c.灼烧固体时应在坩埚中进行,故c错误;
d.检验亚硫酸钠是否被氧化,不能选择硝酸钡和盐酸,因为硝酸钡与盐酸混合,相当于溶液中存在硝酸,则会氧化亚硫酸根离子为硫酸根离子,无法检验原固体是否被氧化,故d错误;
e.无水酒精你能不能作碘的萃取剂,因为酒精与水互溶,故e错误,
故答案为:acde;
(2)①加入足量氯水后溶液变为橙色,说明有溴单质生成,原溶液中存在Br-;且产生气泡,因为氯水呈酸性,与氯水反应产生气体的离子应是CO32-,而不是亚硫酸根离子,因为氯水与亚硫酸根离子发生氧化还原反应生成硫酸根离子;因为含有碳酸根离子,所以A13+、Mg2+不存在,则阳离子只能是Na+;
②加入氯化钡溶液产生不溶于盐酸的白色沉淀,则①所得的溶液中一定含有硫酸根离子,说明原溶液中存在SO32-,被氯水氧化为硫酸根离子,与钡离子反应生成BaSO4白色沉淀;
③说明溶液中不存在I-,其余离子不能确定.所以一定存在的离子是CO32-、SO32-、Br-、Na+;在②中产生的自色沉淀是BaSO4.
故答案为:CO32-、SO32-、Br-、Na+;BaSO4.
点评 本题考查化学实验方案的评价以及离子检验等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的严密性和合理性,难度不大.

| A. |  火力发电 | B. |  硅太阳能电池 | ||
| C. |  用手机打电话 | D. |  用食盐水自制消毒液 |
| A. | 油脂 | B. | 聚乙烯塑料 | C. | 淀粉 | D. | 蛋白质 |
| A. | O | B. | N | C. | Cu | D. | F |
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 液氨作为清洁能源的反应原理是:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 红热的铁丝与水蒸汽接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(气)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 |
(1)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)已知:2N2H4 (1)+N2O4 (1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1
断开1mol下列化学键吸收的能量分别为:N-H:390kJ N-N:190kJ N≡N:946kJ O-H:460kJ.
则使1mol N2O4 (1)分子中化学键完全断裂时需要吸收的能量是1793kJ
(3)已知N2O4 (1)?2NO2(g)△H=+57.20kJ•mol-1,t℃时,将一定量的NO2、N2O4充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(YX)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填序号)
a.增大 b.减小 C.不变 d.无法判断
(4)已知:在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
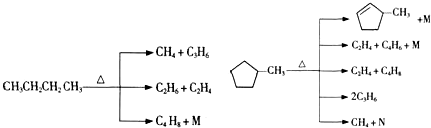
 的说法正确的是A.
的说法正确的是A. 和
和
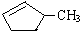 和
和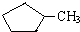 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同 可与水以任意比互溶
可与水以任意比互溶 .
.