题目内容
18.下列叙述中,正确的是( )| A. | 1mol 过氧化钠中阴离子个数为2×6.02×1023 | |
| B. | 14g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023 | |
| C. | 28g C16O与28g C18O中含有的质子数均为14×6.02×1023 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023 |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、乙烯和丙烯的最简式均是CH2;
C、C16O与 C18O的摩尔质量不同;
D、氯气和碱的反应为歧化反应.
解答 解:A.过氧化钠由2个钠离子和1个过氧根构成,故1mol 过氧化钠中含有的阴离子O22-个数为6.02×1023,故A错误;
B.乙烯、丙烯最简式是CH2,式量是14,所以14g乙烯和丙烯的混合物含有最简式的物质的量是1mol,则其中含有的碳原子的数目为6.02×1023,故B正确;
C.C16O与 C18O的式量不相同,即摩尔质量不同,所以所以28g C16O与28g C18O中含有的物质的物质的量不相同,不都是1mol,因此含有的质子数不均为14×6.02×1023,故C错误;
D.标准状况下,22.4L氯气的物质的量是1mol,氯气与NaOH溶液反应的方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,因此1mol氯气与足量氢氧化钠溶液反应转移的电子数为6.02×1023,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.如图装置中,将电能转化为化学能的是( )
| A. |  火力发电 | B. |  硅太阳能电池 | ||
| C. |  用手机打电话 | D. |  用食盐水自制消毒液 |
9.下列解释过程或事实的方程式不正确的是( )
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 液氨作为清洁能源的反应原理是:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 红热的铁丝与水蒸汽接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(气)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 |
6.发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃刹.
(1)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)已知:2N2H4 (1)+N2O4 (1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1
断开1mol下列化学键吸收的能量分别为:N-H:390kJ N-N:190kJ N≡N:946kJ O-H:460kJ.
则使1mol N2O4 (1)分子中化学键完全断裂时需要吸收的能量是1793kJ
(3)已知N2O4 (1)?2NO2(g)△H=+57.20kJ•mol-1,t℃时,将一定量的NO2、N2O4充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
①c(X)代表NO2(填化学式)的浓度,该反应的平衡常数K=0.9;
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填序号)
a.增大 b.减小 C.不变 d.无法判断
(4)已知:在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(1)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)已知:2N2H4 (1)+N2O4 (1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1
断开1mol下列化学键吸收的能量分别为:N-H:390kJ N-N:190kJ N≡N:946kJ O-H:460kJ.
则使1mol N2O4 (1)分子中化学键完全断裂时需要吸收的能量是1793kJ
(3)已知N2O4 (1)?2NO2(g)△H=+57.20kJ•mol-1,t℃时,将一定量的NO2、N2O4充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(YX)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填序号)
a.增大 b.减小 C.不变 d.无法判断
(4)已知:在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,7.8克苯中含0.3NA个碳碳双键 | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |

 .
. .
.
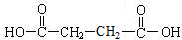 .
.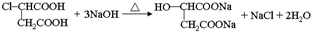 .
.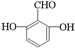 、
、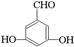 、
、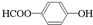 .
. ⑤
⑤

 .
.