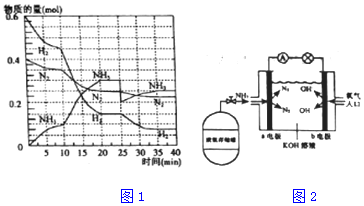
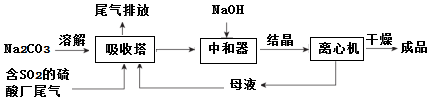
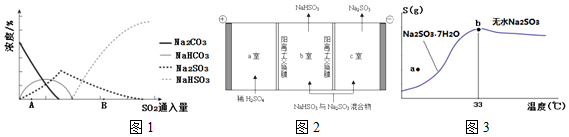
题目内容
4.金属材料在日常生产生活中有着广泛的应用,请回答下列问题:(1)人类最早使用的合金是青铜,目前使用量最大的金属是铁.
(2)向硫酸亚铁溶液中加入过氧化钠,有红褐色沉淀生成,如果加入的Na2O2与生成的O2的物质的量之比为3:1,请写出发生的离子反应方程式3Na2O2+2Fe3++4H2O=2Fe(OH)3+O2+6Na++2OH-.
(3)电子工业需要用30%的FeCl3溶液腐蚀绝缘板上的铜制造印刷电路板.请写出FeCl3溶液与铜反应的离子方程式:2Fe3++Cu═2Fe2++Cu2+,向腐蚀后的废液中加入一定量的铁粉充分反应后,无固体剩余,则反应后的溶液中一定含有的离子是Fe2+、Cu2+、Cl-,可能含有的离子是Fe3+.
(4)有一种铁的氧化物样品,用5mol/L盐酸140mL,恰好完全溶解,所得溶液还能吸收标况下0.56L氯气,恰好使其中Fe2+全部转化成Fe3+,该氧化物的化学式是Fe5O7.
分析 (1)合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,金属大规模被使用的先后顺序跟金属的活动性关系最大,金属活动性较弱时,比较难形成化合物,常以单质形式存在,比较容易被利用;目前使用量最大的合金是铁合金;
(2)Na2O2与生成的O2的物质的量之比为3:1,由电子守恒可知,只有1molNa2O2作氧化剂转移2mol电子;
(3)FeCl3 溶液与铜反应生成氯化铜、氯化亚铁;腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,铁可以置换金属铜,可以和三价铁反应;
(4)n(HCl)=0.14L×5mol/L=0.7mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,反应后溶液成分为FeCl3,结合质量守恒计算.
解答 解:(1)铜的活泼性较弱,比较容易冶炼,所以人类最早使用的合金材料是青铜,目前使用量最大的合金是铁合金,则目前使用量最大的金属是铁,
故答案为:青铜;铁;
(2)Na2O2与生成的O2的物质的量之比为3:1,由电子守恒可知,只有1molNa2O2作氧化剂时转移2mol电子,离子反应为3Na2O2+2Fe3++4H2O=2Fe(OH)3+O2+6Na++2OH-,
故答案为:3Na2O2+2Fe3++4H2O=2Fe(OH)3+O2+6Na++2OH-;
(3)FeC13溶液与铜反应生成氯化亚铁、氯化铜,离子方程式为2Fe3++Cu═2Fe2++Cu2+;腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,加入一定量的铁可以和氯化铁反应生成氯化亚铁,可能与氯化铜反应生成金属铜和氯化亚铁,即Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+,则溶液中一定含Fe2+、Cu2+、Cl-,可能含Fe3+;
故答案为:2Fe3++Cu═2Fe2++Cu2+;Fe2+、Cu2+、Cl-;Fe3+;
(4)n(HCl)=0.14L×5mol/L=0.7mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,则氧化物中n(O)=$\frac{1}{2}$×n(HCl)=$\frac{1}{2}$×0.7mol=0.35mol,
反应后溶液成分为FeCl3,
n(Cl-)=0.7mol+0.025mol×2=0.75mol,
则n(Fe)=0.75mol×$\frac{1}{3}$=0.25mol,
所以:n(Fe):n(O)=0.25mol:0.35mol=5:7,
该氧化物的化学式为Fe5O7,
故答案为:Fe5O7.
点评 本题考查金属及化合物的性质,把握物质的性质、发生的氧化还原反应、离子反应的书写、氧化还原反应计算等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,综合性较强,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| 选项 | 实验目的 | 操作 | 现象 |
| A | BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液中 | KMnO4溶液褪色 |
| D | 验证某化合物一定是钠盐 | 该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |
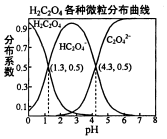 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )
常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )| A. | HC2O4-?H++C2O42-,K=1×10-4.3 | |
| B. | 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液PH恰好为4.3 | |
| C. | 常温下HF的KB=1×10--3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4- | |
| D. | 在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-) |
| A. | 平衡向逆反应方向移动 | B. | B的质量分数增加 | ||
| C. | a>b | D. | A的转化率减小 |
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO两种溶液的c(Na+):①<② | |
| D. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H<0 |
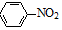 +4Mg+8CH3OH→
+4Mg+8CH3OH→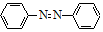 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
 太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )
太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )