题目内容
9.常温下,下列说法错误的是( )| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO两种溶液的c(Na+):①<② | |
| D. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H<0 |
分析 A、根据电荷守恒;
B、水的离子积是温度的函数;
C、次氯酸的酸性比醋酸的酸性弱,NaClO的水解程度大于CH3COONa的水解程度;
D、反应能否自发进行,决定于△H-T△S<0.
解答 解:A、根据电荷守恒得c(H+)+c(Na+)=c (OH-)+2c(SO42-),故A正确;
B、水的离子积是温度的函数,所以0.1 mol/L NaHCO3溶液加水稀释后,溶液的温度不变,c(H+)与c(OH-)的乘积不变,故B正确;
C、pH相同的①CH3COONa、②NaClO,所以醋酸钠的浓度大于次氯酸钠,所以两种溶液的c(Na+):①>②,故C错误;
D、反应物中有气体,生成物中没有气体,故△S<0,若要使反应自发进行,△H-T△S<0,则△H必须小于0,故D正确;
故选C.
点评 本题考查离子浓度的大小,盐的水解、反应方向的判断、水的离子积常数等,难度不大,水的离子积常数是温度的函数.

练习册系列答案
相关题目
20.下列有关说法不正确的是( )
| A. | 常温下干燥的Cl2能用钢瓶贮运 | |
| B. | 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 | |
| C. | SiO2可用于制备光导纤维 | |
| D. | HF溶液不能贮存在磨口玻璃塞的试剂瓶中 |
17.为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( )
| A. | 浓盐酸 | B. | 浓硝酸 | C. | 浓硫酸 | D. | 氢氧化钠溶液 |
1.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

| A. | 原子半径:Z>Y>X | |
| B. | R元素的氧化物对应水化物和W元素的氧化物对应水化物,酸性前者强 | |
| C. | X和Z形成的化合物能溶于NaOH溶液 | |
| D. | Y和X形成的化合物中,阴阳离子的个数比可能为1:1 |
19.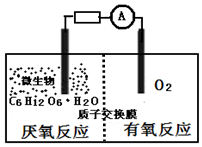 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 负极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从正极区移向负极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |