题目内容
20.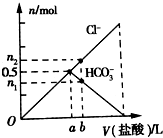 向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )
向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )| A. | 0a段反应的离子方程式为:CO32-+H+=HCO3- | |
| B. | 原Na2CO3溶液中含有0.5mol Na2CO3 | |
| C. | b点时生成的CO2的物质的量为0.1 mol | |
| D. | b点时HCO3-物质的量为0.6mol |
分析 将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O.
A、Oa段反应碳酸钠与盐酸反应生成碳酸氢钠和氯化钠;
B、a点全部生成碳酸氢钠,根据碳守恒分析;
C、Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O,可计算此体积盐酸含氢离子物质的量,求出b点时生成CO2的物质的量;
D、a点全部生成碳酸氢钠,继续加盐酸,碳酸氢钠减少.
解答 解:A、Oa段反应碳酸钠与盐酸反应生成碳酸氢钠和氯化钠,反应的离子方程式为:CO32-+H+=HCO3-,故A正确;
B、a点全部生成碳酸氢钠,根据碳守恒,所以含有0.5mol Na2CO3,故B正确;
C、Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O,可知a到b消耗盐酸的物质的量为:0.6-0.5=0.1mol,由HCO3-+H+=CO2↑+H2O可知,b点时生成CO2的物质的量为0.1mol,故C正确;
D、a点全部生成碳酸氢钠,a点处碳酸氢钠为0.5mol,继续加盐酸,碳酸氢钠减少,所以b点时HCO3-物质的量小于0.5mol,故D错误;
故选D.
点评 本题考查了碳酸钠与盐酸反应的计算,搞清反应原理是关键,注意图象所提供信息,充分利用图象提供数据,题目难度不大,侧重于考查学生的分析能力和读图能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL0.1 mol•L-1氨水与10 mL0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL0.1 mol•L-1NH4Cl溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL0.1 mol•L-1CH3COOH溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
8.某强氧化剂[XO(OH)2]+被亚硫酸钠还原到较低价态.若还原2.4×10-3 mol[XO(OH)2]+,需用30ml0.2mol/L的亚硫酸钠溶液,还原后X的最终化合价为( )
| A. | +2 | B. | +1 | C. | 0 | D. | -2 |
5.下列解释事实或实验现象的化学用语正确的是( )
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 酸性KI淀粉溶液久置后变蓝 4I-+O2+2H2O═2I2+4OH- | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-═SiO32-+H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
12.化学与生产、生活和社会密切相关.下列说法正确的是( )
| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| C. | 使用生物酶降解生活废水中的有机物,可防止水体的富营养化 | |
| D. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
9.下列关于化学用语的表示正确的是( )
| A. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | CO2的比例模型: | |
| D. | 质子数为8,质量数为17的原子:${\;}_{8}^{17}$Cl |
10.实验室存放药品采用分类的方法进行,Na2CO3是实验室常用的一种重要试剂,它不属于下列分类中的( )
| A. | 正盐 | B. | 碱 | C. | 钠盐 | D. | 碳酸盐 |