题目内容
15.(1)亚硫酸钠溶液蒸干得到的固体物质是Na2SO4,原因是Na2SO3在蒸干的过程中不断被空气中的O2氧化而变成Na2SO4.(2)氯化铝溶液蒸干灼烧得到的固体物质是Al2O3.
(3)在干燥的氯化氢气流中加热水含氯化镁(MgCl2•6H2O)晶体,得到的固体物质是MgCl2,原因是在干燥的HCl气流中,HCl抑制Mg2+的水解且带走水蒸气,最终得到无水MgCl2.
分析 (1)亚硫酸钠具有还原性,易被空气中的氧气氧化生成硫酸钠;
(2)氯化铝溶液中铝离子水解溶液显酸性,氯化铝水解生成氢氧化铝和盐酸,蒸干氯化氢挥发,促进水解得到氢氧化铝沉淀,灼烧氢氧化铝分解得到氧化铝;
(3)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解.
解答 解:(1)亚硫酸钠在蒸干的过程中不断被空气氧化而变成硫酸钠,所以最后得到的固体物质是硫酸钠,
故答案为:Na2SO4,Na2SO3在蒸干的过程中不断被空气中的O2氧化而变成Na2SO4 ;
(2)AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,
故答案为:Al2O3 ;
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2,
故答案为:MgCl2,在干燥的HCl气流中,HCl抑制Mg2+的水解且带走水蒸气,最终得到无水MgCl2 .
点评 本题考查盐类水解的应用,题目难度不大,注意盐类水解的原理及亚硫酸钠还原性的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol?1,下列判断正确的是ad.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol?1,则Q<131.4
d.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol?1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
根据表中数据计算:
①0min~2min 内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad.(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为4H++O2+4e-=2H2O.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol?1,下列判断正确的是ad.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol?1,则Q<131.4
d.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol?1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min 内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad.(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为4H++O2+4e-=2H2O.
6.配制100mL 1.0mol/LNa2CO3溶液,下列操作正确的是( )
| A. | 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 定容后,塞好瓶塞,反复倒转、摇匀 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
3.X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,其相关信息如下表:
(1)X位于第二周期IVA族.W的核外电子排布式为1s22s22p63s23p63d64s2.
(2)Y、Z、V对应简单离子半径由大到小的顺序为S2->O2->Na+.(书写离子符号),写出Z2Y2与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体.请写出化学反应方程式:
(4)已知W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1
则相同,反应WY(s)+XY(g)=W(s)+XY2(g)△H=+7.3 kJ•mol-1.
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
(2)Y、Z、V对应简单离子半径由大到小的顺序为S2->O2->Na+.(书写离子符号),写出Z2Y2与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体.请写出化学反应方程式:
(4)已知W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1
则相同,反应WY(s)+XY(g)=W(s)+XY2(g)△H=+7.3 kJ•mol-1.
10.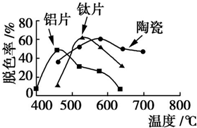 在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
 在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )| A. | 不同载体,无论何种温度一定是钛片载体的光催化活性最好 | |
| B. | 无论何种载体,催化活性总是随温度的升高而升高 | |
| C. | 约在520℃时,钛片载体的光催化活性最好 | |
| D. | 不同载体,TiO2薄膜的光催化活性相同 |
20.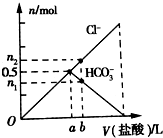 向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )
向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )
 向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )
向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )| A. | 0a段反应的离子方程式为:CO32-+H+=HCO3- | |
| B. | 原Na2CO3溶液中含有0.5mol Na2CO3 | |
| C. | b点时生成的CO2的物质的量为0.1 mol | |
| D. | b点时HCO3-物质的量为0.6mol |
7.实验室配制250ml 0.200mol/L NaCl溶液,下列操作导致所配溶液浓度偏低的是( )
| A. | 容量瓶洗净后未干燥 | |
| B. | 移液后烧杯未洗涤 | |
| C. | 定容时俯视读数 | |
| D. | 摇匀后液面低于刻度线再滴加水至刻度线 |
5.根据你所学知识,判断下列类推结论中正确的是( )
| 化学事实 | 类推结论 | |
| A | 常温下,pH=3的盐酸稀释1000倍后pH=6 | 常温下,pH=6的盐酸稀释1 000倍后pH=9 |
| B | 电解熔融MgCl2可制取金属镁 | 电解熔融AlCl3也可制取金属铝 |
| C | Na着火不能用干冰灭火 | K着火也不能用干冰灭火 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |