题目内容
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.为此,他们设计了如题装置验证所产生的气体.

(1)G装置的作用是 .
(2)证明有SO2生成的现象是 ,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 、 .
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 .

(1)G装置的作用是
(2)证明有SO2生成的现象是
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是
考点:实验装置综合,浓硫酸的性质实验
专题:实验设计题
分析:(1)如果没有G装置,水蒸气进入F装置干扰实验,
(2)二氧化硫有还原性,能使酸性高锰酸钾溶液褪色;氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色;
(3)因为浓硫酸中的水很少,而且浓硫酸具有吸水性.
(2)二氧化硫有还原性,能使酸性高锰酸钾溶液褪色;氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色;
(3)因为浓硫酸中的水很少,而且浓硫酸具有吸水性.
解答:
解:(1)如果没有G装置,水蒸气进入F装置干扰实验,所以G的作用是:防止空气中的H2O进入F,
故答案为:防止空气中的H2O进入F;
(2)二氧化硫有还原性,酸性高锰酸钾有强氧化性,二者能发生氧化还原反应而使酸性高锰酸钾溶液褪色;氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 氧化铜、无水硫酸铜,
故答案为:酸性高锰酸钾溶液颜色褪色;CuO;CuSO4;
(3)因为浓硫酸中的水很少,浓硫酸有吸水性,硫酸铜不能溶于浓硫酸,所以反应后生成的硫酸铜大多没有溶解出现预计的蓝色溶液,而以白色固体形式存在,
故答案为:浓硫酸中的水很少,浓硫酸有吸水性.
故答案为:防止空气中的H2O进入F;
(2)二氧化硫有还原性,酸性高锰酸钾有强氧化性,二者能发生氧化还原反应而使酸性高锰酸钾溶液褪色;氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 氧化铜、无水硫酸铜,
故答案为:酸性高锰酸钾溶液颜色褪色;CuO;CuSO4;
(3)因为浓硫酸中的水很少,浓硫酸有吸水性,硫酸铜不能溶于浓硫酸,所以反应后生成的硫酸铜大多没有溶解出现预计的蓝色溶液,而以白色固体形式存在,
故答案为:浓硫酸中的水很少,浓硫酸有吸水性.
点评:本题考查了常见气体的制备原理及其性质,和气体的检验等知识点,题目难度不大,明确二氧化硫和氢气的性质是解本题的关键,注意把握浓硫酸的组成和浓硫酸的吸水性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作能达到预期目的是( )
| A、向某无色溶液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- |
| B、向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- |
| C、向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ |
| D、将某溶液进行焰色反应时,火焰呈黄色,则溶液中一定无K+ |
在2mL物质的量浓度相等的NaCl和NaI溶液中滴入几滴AgNO3溶液,发生的反应为( )
| A、只有AgCl沉淀生成 |
| B、只有AgI沉淀生成 |
| C、生成等物质的量的AgCl和AgI沉淀 |
| D、两种沉淀都有,但以AgI为主 |
在一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s)?Ca2+(aq)+2OHˉ(aq),向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度.下列叙述正确的是( )
| A、溶液中钙离子数目减小 |
| B、溶液中钙离子浓度减少 |
| C、溶液中氢氧根离子浓度增大 |
| D、pH减小 |
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.30kJ?mol-1,在某温度下,2L的密闭容器中进行,测得如下数据:下列说法正确的是( )
 | 0 | 1 | 2 | 3 |
| N2 | 1.50 | n1 | 1.20 | n3 |
| H2 | 4.50 | 4.20 | 3.60 | n4 |
| NH3 | 0 | 0.20 | n2 | 1.00 |
| A、反应进行到1小时时放出的热量为9.23kJ |
| B、反应3h内,反应速率v(N2)为0.17mol?L-1?h-1 |
| C、此温度下,该反应的平衡常数为0.037 |
| D、4h时,若再加入1molN2,达到新的平衡时,N2的转化率是原来的两倍 |
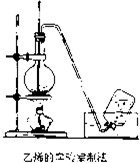 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题: (1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为
(1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为