题目内容
16.下列事实不能用平衡移动原理解释的是( )| A. | 蒸干AlCl3溶液,无法得到无水AlCl3 | |
| B. | 用稀H2SO4洗涤BaSO4沉淀,可减少沉淀损失量 | |
| C. | 氯水中加入少量CaCO3粉末,可以提高漂白能力 | |
| D. | 滴加CuSO4溶液可以加快Zn与稀H2SO4反应的速率 |
分析 A、AlCl3溶液在加热时水解生成Al(OH)3,加热促进水解;
B、硫酸钡溶液中存在溶解平衡,所以加入硫酸,硫酸根离子浓度变大,平衡逆向移动;
C、氯水中存在氯气与水反应生成次氯酸,加入碳酸钙与盐酸反应,而HClO和碳酸钙不反应,平衡正向移动,则HClO的浓度增大;
D、滴加少量CuSO4溶液,少量的锌与铜离子反应生成铜,铜与锌和硫酸构成原电池加快反应速率.
解答 解:A、AlCl3溶液在加热时水解生成Al(OH)3,加热促进水解,所以符合平衡移动原理,故A正确;
B、硫酸钡溶液中存在溶解平衡,所以加入硫酸,硫酸根离子浓度变大,平衡逆向移动,可减少沉淀损失,所以符合平衡移动原理,故B正确;
C、氯水中存在氯气与水反应生成次氯酸,加入碳酸钙与盐酸反应,而HClO和碳酸钙不反应,平衡正向移动,则HClO的浓度增大,所以符合平衡移动原理,故C正确;
D、滴加少量CuSO4溶液,少量的锌与铜离子反应生成铜,铜与锌和硫酸构成原电池加快反应速率,不符合平衡移动原理,故D错误;
故选D.
点评 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查,试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列物质属于碱的是( )
| A. | KCl | B. | Cu2(OH)2CO3 | C. | Na2CO3 | D. | NaOH |
7.下列化合物中,属于碱的是( )
| A. | MgO | B. | SO2 | C. | H2SO4 | D. | Ca(OH)2 |
4.将0.2mol•L-1的HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
| A. | c(HCN)<c(CN-) | B. | c(Na+)>c(CN-) | ||
| C. | c(HCN)-c(CN-)=c(OH-) | D. | c(HCN)+c(CN-)=0.2mol•L-1 |
11.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种.向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中加入盐酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀.则下列结论正确的是( )
| A. | 原气体中肯定有SO2,可能有HCl | B. | 原气体中肯定没有H2S、HBr和CO2 | ||
| C. | 原气体中肯定有SO2和 HCl | D. | 原气体中肯定没有CO2 |
1.下列离子方程式书写不正确的是( )
| A. | 将H2S气体通入Fecl3溶液中:H2S+2Fe3+=2Fe2++S↓+2H+ | |
| B. | Si与NaOH溶液反应:Si+2OH-+H2O=SiO32-+2H2↑ | |
| C. | 将Cl2和SO2体积比1:1同时通入水中:Cl2+SO2+2H2O=4H++SO42-+2Cl- | |
| D. | 将CO2气体通入饱和Na2CO3溶液中:CO2+H2O+CO32-=2HCO3- |
8.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 原子核内有10个中子的氧原子:${\;}_{\;}^{18}$O | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | CH4分子的比例模型: | |
| D. | 乙炔分子的电子式: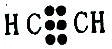 |
5.某有机物的分子式为C8H8,经研究表明该有机物不能发生加成反应和加聚反应.在常温下难于被酸性KMnO4溶液氧化.但在一定条件下却可与Cl2发生取代反应.而且其一氯代物只有一种.下列对该有机物结构的推断中一定正确的是( )
| A. | 该有机物中含有碳碳双键 | B. | 该有机物属于芳香烃 | ||
| C. | 该有机物分子具有平面环状结构 | D. | 该有机物具有三维空间的立体结构 |
6.下列各组物质中,前者为电解质,后者为非电解质的是( )
| A. | 硫酸,硫酸钡 | B. | NH3,氢氧化钠 | C. | 盐酸,醋酸 | D. | 食盐,酒精 |