题目内容
8.下列表述正确的是( )| A. | 二氧化硫、氨、煤的液化均为物理变化 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次降低 | |
| D. | 已知常温下氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中:c(OH-)=$\root{3}{a}$mol/L |
分析 A.煤的液化是化学变化;
B.乙醇的催化氧化机理分析判断,羟基氢和羟基碳上的氢原子去氢氧化;
C.相对分子质量越大,氢键数目越多,则熔沸点越大;
D.氢氧化镁悬浊液中满足:c(OH-)=2c(Mg2+),结合溶度积的表达式计算.
解答 解:A.二氧化硫、氨的液化为物理变化,煤液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,故A错误;
B.乙醇的催化氧化机理分析判断,羟基氢和羟基碳上的氢原子去氢氧化,重氢在水中,化学方程式为2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO,故B正确;
C.甲醇、乙二醇、丙三醇相对分子质量逐渐增大,氢键数目增多,则甲醇、乙二醇、丙三醇的沸点依次升高,故C错误;
D.氢氧化镁悬浊液中:c(OH-)=2c(Mg2+),则:c(OH-)=$\root{3}{2a}$mol/L,故D错误;
故选B.
点评 本题考查较为综合,涉及难溶物溶度积的计算、有机物结构与性质、有机反应方程式书写、煤的液化等知识,题目难度中等,注意掌握溶度积常数的表达式,明确常见有机物结构与性质,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
15.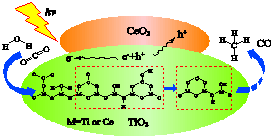 2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )
2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )
 2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )
2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )| A. | 此反应可将光能转化为化学能 | |
| B. | CO2和CH4均含极性共价键 | |
| C. | 产物可能还有O2 | |
| D. | CO2溶于水呈酸性的原因:CO2+H2O?H2CO3H2CO3?2H++CO32- |
16.已知Ksp(AgCl)=2×10-10,Ksp(Ag2CO3)=1×10-11;一定温度下,将0.1mol AgCl加入1L0.1mol•L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),下列在关说法正确的是( )
| A. | 与水相比,AgCl在Na2CO3溶液中的溶解度及溶度积均增大 | |
| B. | 反应后的溶液中:c(Na+)>c(CO32-)>c(Cl-)=c(Ag+)>c(OH-)>c(H+) | |
| C. | 溶液中c(Cl-)=2×10-5mol•L-1 | |
| D. | 沉淀转化反应;2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为2×10-9 |
13.下列方程式中,不正确的是( )
| A. | 乙酸在水中电离:CH3COOH?H++CH3COO- | |
| B. | 乙烷和溴蒸气的混合物光照后发生反应:CH3CH3+Br2$\stackrel{光}{→}$CH3CH2Br+HBr | |
| C. | 苯在浓硫酸并加热条件下与浓硝酸发生反应: +HNO3$→_{50~60℃}^{浓硫酸}$ +HNO3$→_{50~60℃}^{浓硫酸}$ +H2O +H2O | |
| D. | 乙酸、乙醇和浓硫酸的混合物在加热条件下发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 |
3.乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发挥.它在多种生物化学过程中起作用.某学习小组研究利用发酵法制乳酸菌以及探讨乳酸的部分性质.

实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180于烧杯中,加入乳酸菌(厌氧)发酵,72小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
(1)仪器A是500mL容量瓶;
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%.
实验(二):乳酸的性质
已知乳酸的Ka=1.4×10-4,碳酸的Ka1=4.47×10-3
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸).
(5)小组利用如图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱.

①可观察到烧杯中的现象是溶液出现白色浑浊;写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.

实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180于烧杯中,加入乳酸菌(厌氧)发酵,72小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%.
实验(二):乳酸的性质
已知乳酸的Ka=1.4×10-4,碳酸的Ka1=4.47×10-3
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸).
(5)小组利用如图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱.

①可观察到烧杯中的现象是溶液出现白色浑浊;写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
18.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气.若砷的质量为1.50mg,则下列说法正确的是( )
| A. | 被氧化的砒霜为1.98mg | B. | 分解产生的氢气为0.672ml | ||
| C. | 转移的电子总数为0.18NA | D. | 和砒霜反应的锌为3.90mg |
 .
.