题目内容
13.有关物质结构的下列说法中正确的是( )| A. | 碘升华时破坏了共价键 | |
| B. | PH3沸点低于NH3沸点,因为P-H键键能低 | |
| C. | HF的分子间作用力(含有氢键)大于HCl,故HF比HCl更稳定 | |
| D. | 氯化钠固体中的离子键在溶于水时被破坏 |
分析 A、根据是否发生化学反应判断化学键是否被破坏;
B、氢键的存在物质的熔沸点异常的高;
C、稳定性是化学性质,氢键无关;
D、电解质溶于水时会发生电离;
解答 解:A、碘升华属于物理变化,破坏的是分子间作用力,没有破坏共价键,故A错误;
B、NH3分子间存在氢键,所以沸点高于PH3沸点,故B错误;
C、稳定性是化学性质,氢键无关,而HF比HCl更稳定是因为氢氟键的键长短,故C错误;
D、电解质溶于水时会发生电离,所以氯化钠固体中的离子键在溶于水时被破坏,故D正确;
故选D.
点评 本题考查了化学键、分子间作用力、氢键、离子键等,侧重考查学生对概念的辨别能力,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8g O2的体积为5.6L | |
| B. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| C. | 标准状况下,50mL 0.2mol•L-1的盐酸中含有分子数为0.01NA | |
| D. | 常温常压下,10g氖气含有的原子数为0.5NA个 |
1.一定条件下,H2O2在水溶液中发生分解反应:2H2O2$\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑.反应过程中,测得不同时间H2O2的物质的量浓度如下表所示:
(1)在H2O2分解反应中,氧化产物和还原产物的质量之比是8:9.
(2)在0-20min时间内,该反应的平均反应速率v(H2O2)=0.02mol/(L•min).
(3)若反应所用的H2O2溶液为100mL(忽略溶液体积的变化),则80min时,反应共产生O21.44g.
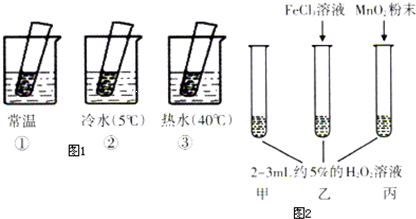
(4)如图1、图2是某学生探究外界条件对H2O2分解反应速率的影响实验装置示意图,请按表格要求填写空白.
实验一:(试管中均为滴有FeCl3溶液的5%H2O2溶液)
实验二:
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 1.0 | 0.60 | 0.40 | 0.20 | 0.10 |
(2)在0-20min时间内,该反应的平均反应速率v(H2O2)=0.02mol/(L•min).
(3)若反应所用的H2O2溶液为100mL(忽略溶液体积的变化),则80min时,反应共产生O21.44g.
(4)如图1、图2是某学生探究外界条件对H2O2分解反应速率的影响实验装置示意图,请按表格要求填写空白.
实验一:(试管中均为滴有FeCl3溶液的5%H2O2溶液)
| 现象 | 结论 | |
| 热水中 | 溶液中有气泡产生,比常温快 | 升高温度,H2O2的分解速率加快 |
| 常温中 | 溶液中有气泡产生,且速度较快 | 无 |
| 冷水中 | 溶液中有气泡产生,比常温慢 | 降低温度,H2O2的分解速率减慢 |
| 现象 | 结论 | |
| 丙加入MnO2 | MnO2能加快化学反应速率 | |
| 乙加入FeCl3 | FeCl3能加快化学反应速率 | |
| 甲不加其他试剂 | 溶液中有少量气泡出现 | 不使用催化剂化学反应速率较小 |

8.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | NaAlO2 和 HCl | B. | MgCl2和 NH3•H2O | C. | Na2CO3和HCl | D. | AlCl3和NaOH |
18.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是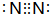 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是
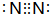 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
5.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 500℃左右比室温更有利于合成氨的反应(△H<0) | |
| C. | 红棕色的NO2加压后颜色先变深再变浅(2 NO2?N2O4(无色)) | |
| D. | 光照新制的氯水时,溶液的pH逐渐减小 |
3.常温下向20.00mL 0.10mol/L Na2CO3溶液中逐滴加入0.10mol/L盐酸40.00mL,所得溶液的pH与加入盐酸体积的关系如表所示:
回答下列问题:
(1)20.00mL0.10mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-)(用等式表示).
(2)当V(HCl)=20.00mL时,溶液呈碱性的原因是溶液中存在平衡:HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,HCO3-的水解程度大于电离程度,溶液呈碱性(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)>(填“>”、“<”或“=”)c(CO32-).
(3)V(HCl)=40.00mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的电离常数K1=2.5×10-6.此时保持其他条件不变,继续加入0.1mol/L盐酸10.00mL,K1将不变(填“变大”、“变小”或“不变”).
(4)若向20mL0.10mol/LNa2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(BaCO3)=9.5×10-9.
| 溶液的pH | 加入盐酸的总体积 |
| 12 | V(HCl)=0 |
| 8 | V(HCl)=20.00mL |
| 5 | V(HCl)=40.00mL |
(1)20.00mL0.10mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-)(用等式表示).
(2)当V(HCl)=20.00mL时,溶液呈碱性的原因是溶液中存在平衡:HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,HCO3-的水解程度大于电离程度,溶液呈碱性(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)>(填“>”、“<”或“=”)c(CO32-).
(3)V(HCl)=40.00mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的电离常数K1=2.5×10-6.此时保持其他条件不变,继续加入0.1mol/L盐酸10.00mL,K1将不变(填“变大”、“变小”或“不变”).
(4)若向20mL0.10mol/LNa2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(BaCO3)=9.5×10-9.
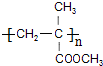 .
.