题目内容
11.(1)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL①三种溶液中物质的量浓度最大的是CH3COOH(aq).
②分别用0.1mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是CH3COOH(aq).
③反应开始时,反应速率D.
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时c(OH -)=2.0×10-7mol/L.
(3)室温时,将pH=12的Ba(OH)2溶液和pH=9的KOH溶液按1:1的体积比混合,则混合后溶液中的c(H+)≈2×10-12mol/L(计算结果用a×10n的形式表示,a为小于10的正整数)
分析 (1)①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比;②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比;③反应速率与氢离子浓度成正比;
(2)纯水中c(H+)=c(OH-),水的离子积Kw=c(H+).c(OH-);
(3)pH=12的Ba(OH)2溶液中c(OH-)=10-2mol•L-1,pH=9的KOH溶液c(OH-)=10-5mol•L-1,按1:1的体积比混合,首先求混合后氢氧根离子的浓度,然后再根据Kw=c(OH-)×c(H+)=10-14,可计算出c(H+).
解答 解:(1)①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比,所以pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)溶液其浓度大小顺序是CH3COOH>HCl>H2SO4,则浓度最大的是CH3COOH;
故答案为:CH3COOH;
②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比,pH相等、体积相等的硫酸和盐酸中氢离子的物质的量相等,醋酸的物质的量浓度最大,则相同体积同pH的醋酸和盐酸,醋酸的物质的量大于盐酸,所以消耗氢氧化钠体积最多的是CH3COOH;
故答案为:CH3COOH;
③反应速率与氢离子浓度成正比,开始时,三种酸中氢离子浓度相等,所以其开始反应速率相等,
故答案为:D;
(2)任何温度下,纯水均显中性,即纯水中都存在c(H+)=c(OH-)=2.0×10-7mol/L,
故答案为:2.0×10-7;
(3)pH=12的Ba(OH)2溶液中c(OH-)=10-2mol•L-1,pH=9的KOH溶液c(OH-)=10-5mol•L-1,按1:1的体积比混合后c(OH-)=$\frac{1×1{0}^{-2}+1×1{0}^{-5}}{2}$mol•L-1,c(H+)=$\frac{{K}_{W}}{C(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{\frac{1×1{0}^{-2}+1×1{0}^{-5}}{2}}$≈2×10-12mol/L,
故答案为:2×10-12.
点评 本题考查较综合,涉及弱电解质的电离、酸碱混合溶液定性判断、反应速率的判断等知识点,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铜锌原电池工作时,电子从铜电极流向锌电极 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
| A. | K3C60的摩尔质量是837 | |
| B. | 1 mol K3C60中含有的离子数目为63×6.02×1023 | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式可写为KC20 |
| A | ①能使溴的四氯化碳溶液褪色,常作植物生长调节剂; ②比例模型如图所示:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型如图所示: 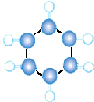 |
| C | ①C、H、O三种元素组成; ②与Na反应产生H2; ③与D反应可生成酯. |
| D | ①C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红. |
(1)写出A、C的结构简式:ACH2=CH2,CC2H5OH或者CH3CH2OH;B的分子式为C6H6.
(2)D物质中存在的官能团名称为羧基.
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(4)C催化氧化生成乙醛的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O.
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法不正确的是( )
| A. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 | |
| B. | 湿法中FeO42-是氧化产物;干法中O2也是氧化产物 | |
| C. | 干法中每生成1mol Na2FeO4,这个反应共转移4mol电子 | |
| D. | 高铁酸钠中铁显+6价,它在氧化还原反应中通常被还原 |
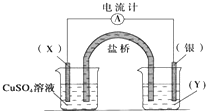 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: