题目内容
1mol氢气燃烧时约放热286kJ,而1g汽油燃烧时约放热46kJ.请回答:
(1)等质量的氢气和汽油相比,哪种放出的热量多? .
(2)氢气被公认是21世纪替代矿物燃料的理想能源,试简述氢气作为能源的三个主要优点:
① ;② ;③ .
(3)实验室可用金属锌与盐酸反应来制取氢气,有关的反应原理为(用化学方程式表示) .
(1)等质量的氢气和汽油相比,哪种放出的热量多?
(2)氢气被公认是21世纪替代矿物燃料的理想能源,试简述氢气作为能源的三个主要优点:
①
(3)实验室可用金属锌与盐酸反应来制取氢气,有关的反应原理为(用化学方程式表示)
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:(1)根据题意1kg氢气燃烧放的热量和1kg汽油燃烧时放热进行比较,得出答案;
(2)根据氢气的性质和燃烧的产物来回答;
(3)实验室利用“活泼金属置换酸中的氢”制取氢气,活泼金属通常选用反应速度适中的锌粒,酸可使用盐酸.
(2)根据氢气的性质和燃烧的产物来回答;
(3)实验室利用“活泼金属置换酸中的氢”制取氢气,活泼金属通常选用反应速度适中的锌粒,酸可使用盐酸.
解答:
解:(1)根据题意1molH2为2g,燃烧时约放热286kJ,则1gH2燃烧放热为:286kJ×
=1.43×105 kJ>4.6×104kJ,所以燃烧等质量的氢气,比汽油放出的热量多,
故答案为:等质量的氢气和汽油相比,氢气放出的热量多;
(2)氢气作为能源的三个主要优点①来源丰富;②单位质量的氢燃烧时释放的热量大;③燃烧后不产生污染,
故答案为:来源丰富;单位质量的氢燃烧时释放的热量大;燃烧后不产生污染;
(3)用金属锌与盐酸反应来制取氢气,反应的原理是:Zn+2HCl=ZnCl2+H2↑,故答案为:Zn+2HCl=ZnCl2+H2↑.
| 1 |
| 2 |
故答案为:等质量的氢气和汽油相比,氢气放出的热量多;
(2)氢气作为能源的三个主要优点①来源丰富;②单位质量的氢燃烧时释放的热量大;③燃烧后不产生污染,
故答案为:来源丰富;单位质量的氢燃烧时释放的热量大;燃烧后不产生污染;
(3)用金属锌与盐酸反应来制取氢气,反应的原理是:Zn+2HCl=ZnCl2+H2↑,故答案为:Zn+2HCl=ZnCl2+H2↑.
点评:本题考查反应热的比较、氢能的优点、实验室制取氢气的原理,比较基础,平时注意基础知识的积累,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 已知反应2H2(g)+CO(g)?CH3OH(g)的平衡常数如表.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列大小比较正确的是( )
已知反应2H2(g)+CO(g)?CH3OH(g)的平衡常数如表.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列大小比较正确的是( )| 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |
| A、平衡常数:K(a)>K(c),K(b)=K(d) |
| B、正反应速率:v(a)>v(c),v(b)=v(d) |
| C、达到平衡所需时间:t(a)=t(c),t(b)>t(d) |
| D、平均相对分子质量:M(a)=M(c),M(b)>M(d) |
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: 某温度时,在2L容器中某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析得: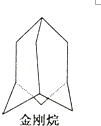 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.