题目内容
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)加入NaOH溶液0--20mL过程中反应方程式为:
(2)合金中Mg的质量为
考点:化学方程式的有关计算
专题:计算题
分析:(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O;
(2)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量;
沉淀量最大时,溶液为氯化钠溶液,根据钠元素守恒:n(NaCl)=n(NaOH),根据氯离子守恒:n(HCl)=n(NaCl),再利用c=
计算盐酸的物质的量浓度.
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O;
(2)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量;
沉淀量最大时,溶液为氯化钠溶液,根据钠元素守恒:n(NaCl)=n(NaOH),根据氯离子守恒:n(HCl)=n(NaCl),再利用c=
| n |
| V |
解答:
(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为:Al(OH)3+NaOH=NaAlO2+2H2O;
故答案为:HCl+NaOH=NaCl+H2O;Al(OH)3+NaOH=NaAlO2+2H2O;
(2)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g;
沉淀量最大,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯离子守恒:n(HCl)=n(NaCl)=0.8mol,故盐酸的物质的量浓度为
=8mol/L,
故答案为:4.8;8.
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为:Al(OH)3+NaOH=NaAlO2+2H2O;
故答案为:HCl+NaOH=NaCl+H2O;Al(OH)3+NaOH=NaAlO2+2H2O;
(2)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g;
沉淀量最大,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯离子守恒:n(HCl)=n(NaCl)=0.8mol,故盐酸的物质的量浓度为
| 0.8mol |
| 0.1L |
故答案为:4.8;8.
点评:本题以图象题的形式,考查镁铝化合物性质、混合物的计算,分析图象各阶段的发生的反应是解题关键,再利用守恒计算,题目难度中等.

练习册系列答案
相关题目
油脂的下列性质和用途中,与其含有不饱和碳碳双键有关的是( )
| A、油脂是产生能量最高的营养物质 |
| B、植物油通过氢化可以变为脂肪 |
| C、脂肪是有机体组织里储存能量的重要物质 |
| D、利用油脂在碱性条件下的水解,可以制甘油和肥皂 |
有关纯碱和小苏打的叙述正确的是( )
| A、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 |
| B、等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,NaHCO3消耗盐酸体积多 |
| C、等质量的Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多 |
| D、Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应 |
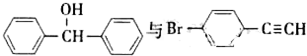 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为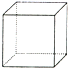 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.